结直肠癌(Colorectal cancer, CRC)是我国发病率和死亡率最高的癌症之一,手术切除仍是I-III期CRC最主要的治疗手段。然而,即使是根治术后仍有的30-50%的肠癌患者会发生复发转移。根治性手术联合辅助化疗是III期结肠癌患者的标准治疗策略。根据目前的临床指南,临床医生主要根据III期肠癌患者的临床复发风险来制定辅助化疗疗程,低危患者推荐行3个月联合化疗,而高危患者推荐行6个月的联合化疗。目前,仍需要更精确地生物学标志物来指导III期肠癌患者的个体化辅助治疗。

图1. 彭俊杰教授团队在European Journal of Cancer杂志发表重要研究成果
循环肿瘤DNA(ciruculating tumor DNA, ctDNA)是目前公认的检测术后微小残留病变(minimal residual disease,MRD)的有力工具,MRD与复发和预后密切相关。而CMS分型可反映肠癌本身内在的分子特征,CMS4型的肠癌具有干性特征及间质型特征,生物学行为侵袭性强,且对治疗的敏感性差,预后较差。为了证实将ctDNA与CMS分型联合是否能够更好的对III期肠癌患者进行风险分层,复旦大学附属肿瘤医院大肠综合治疗科主任彭俊杰教授团队开展了一项前瞻性、观察性的单中心研究,相关研究成果发表在European Journal of Cancer(图1)。
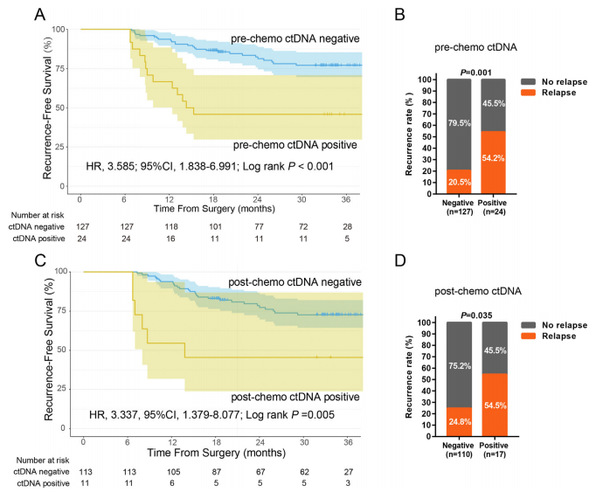
图2. 不同ctDNA状态的肠癌患者无复发生存状态的生存曲线及对比情况
该研究共前瞻性纳入了165例III期结肠癌患者,分别收集患者术后及化疗后的血浆,提取ctDNA进行197癌症相关基因的DNA测序,同时收集患者的手术切除肿瘤组织进行788基因的靶向RNA测序进行CMS分型。在术后标本中,ctDNA的阳性率为15.9%;在化疗后标本中,ctDNA的阳性率为8.9%。与ctDNA阴性患者相比,术后ctDNA阳性患者复发风险增加3.6倍,化疗后ctDNA阳性患者复发风险增加3.3倍(图2)。

图3. 不同CMS分型及临床复发风险的肠癌患者无复发生存状态的生存曲线
反应肿瘤本身生物学特性的CMS分型及临床复发风险分层均显示出了其预后预测能力。CMS4型肠癌患者的复发风险是CMS1-3型患者的2.1倍;高危患者的复发风险是低危患者的3.3倍。
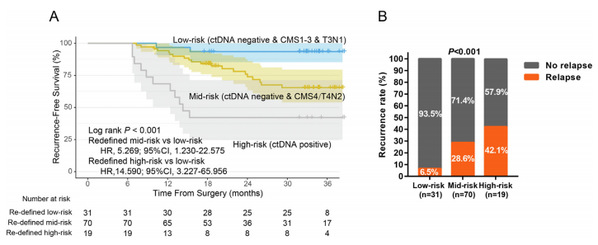
研究团队将ctDNA、CMS分型及临床风险结合,提出了新的III期肠癌风险分层方法:ctDNA阴性、CMS1-3型且病理分期为T3N1的患者为低危患者;ctDNA阴性、CMS4型且病理分期为T4/N2的患者为中危患者;ctDNA阳性的患者为高危患者。研究结果显示,与重新定义的低危患者相比,中危患者的复发风险增加5.3倍,而高危患者的复发风险则增高14.6倍。在重新定义的风险分层体系下,低危患者占据所有患者的25.8%,该亚组的患者3年RFS高达93.5%,相当于I期肠癌患者,该亚组患者是否仍需要辅助化疗,需要前瞻性干预性临床试验的进一步证实。
该研究证实ctDNA可用于肠癌术后复发风险的预测,术后ctDNA阳性患者的肿瘤复发风险显著增高。但是,在重视ctDNA检测发现肿瘤参与的同时,我们也不能忽视了肿瘤本身分子特性的重要性;将ctDNA与CMS分型二者联合,能够更好的肿瘤进行风险分层,从而指导个体化治疗。
复旦大学附属肿瘤医院彭俊杰教授、盛伟琪教授和蔡三军教授为本文的通讯作者,李雅琪博士和莫少波博士为论文的共同第一作者。彭俊杰教授团队一直致力于推进液体活检在肠癌中的临床应用研究。彭俊杰教授团队参与及领衔的ctDNA在肠癌早筛及II-III期复发风险预测方面的研究已经相继发表于Journal of Hematology & Oncology(影响因子17.388)及Molecular Cancer(影响因子27.4)[2-4]。此外,彭俊杰教授在研并即将开展多项多项ctDNA在肠癌中的临床应用研究,包括ctDNA在高危II期及III期肠癌复发转移监测中的作用、ctDNA在IV期肠癌患者NED后复发转移监测中的作用及ctDNA在肠癌肺转移患者的干预性监测作用等,欢迎广大肠癌患者积极参与。
参考文献:
[1] Li Y, Mo S, Zhang L, Ma X, Hu X, Huang D, et al. Postoperative circulating tumor DNA combined with consensus molecular subtypes can better predict outcomes in stage III colon cancers: A prospective cohort study, Eur J Cancer 2022;169: 198-209.
[2] Bao H, Wang Z, Ma X, Guo W, Zhang X, Tang W, et al. An ultra-sensitive assay using cell-free DNA fragmentomics for multi-cancer early detection. Mol Cancer 2022; accepted.
[3] Chen G, Peng J, Xiao Q, Wu HX, Wu X, Wang F, et al. Post operative circulating tumor DNA as markers of recurrence risk instages II to III colorectal cancer. J Hematol Oncol 2021;14:80.
[4] Ma X, Chen Y, Tang W, Bao H, Mo S, Liu R, et al. Multi-dimensional fragmentomic assay for ultrasensitive early detection of colorectal advanced adenoma and adenocarcinoma. J Hematol Oncol2021;14(1):175.




