近年来研究表明,单纯靶向肿瘤细胞的治疗方式并不能获得良好的治疗效果。作为孕育乳腺肿瘤的“土壤”—乳腺肿瘤微环境是影响肿瘤治疗疗效的重要因素之一。在肿瘤组织定植的微生物中,肠道菌群通过多重机制引起肿瘤生物学特性的改变,进而影响肿瘤治疗响应。其中,产肠毒素脆弱拟杆菌ETBF被报道可通过分泌毒蛋白BFT促进乳腺癌恶性。然而介导乳腺癌化疗响应的关键菌群及其作用机制等一系列重要问题仍不清楚。回答这些关键问题解将为我们进一步理解乳腺癌肿瘤微生态,探索新的乳腺癌治疗策略带来希望。
2024年3月4日,复旦大学生物医学研究院/附属肿瘤医院柳素玲团队在Protein & Cell杂志在线发表了题为Microbiota enterotoxigenic Bacteroides fragilis-secreted BFT-1 promotes breast cancer cell stemness and chemoresistance through its functional receptor NOD1的研究性论文,发现脆弱拟杆菌ETBF在化疗不响应的乳腺癌病人癌组织中富集,同时固有免疫受体NOD1在这些病人癌组织中高表达。体内外实验证实,ETBF分泌的毒蛋白BFT-1可通过与乳腺肿瘤干细胞上高表达的NOD1结合,促进NUMB的溶酶体降解,进而激活NOTCH1-HEY1通路,促进乳腺肿瘤细胞干性和对多西他赛的化疗耐药。利用清除ETBF的抗生素甲硝唑联合NOD1抑制剂Nodinitib-1和多西他赛,可有效抑制乳腺肿瘤细胞增殖及干性。其中,甲硝唑和Nodinitib-1联用显著增加乳腺癌对多西他赛的敏感性。该研究明确了肿瘤干细胞高表达的NOD1介导乳腺肿瘤细胞与菌群ETBF互作并导致乳腺癌多西他赛耐药的功能和具体分子机制,发现预测乳腺癌多西他赛耐药的分子标志物,并提出逆转乳腺癌多西他赛耐药的“三药联合”治疗策略。

为了寻找乳腺癌组织中可能介导乳腺癌新辅助化疗耐药的关键菌群,作者对化疗响应不同的乳腺癌患者肿瘤组织开展了16S rRNA测序,发现产肠毒素脆弱拟杆菌ETBF在新辅助化疗不响应的病人癌组织中富集。同时在这些组织中,他们观察到固有免疫模式识别受体NOD1表达升高,其介导的下游Notch1信号通路被激活。通过FISH和免疫组化实验联合分析表明,NOD1高表达且ETBF富集的三阴性乳腺癌病人其化疗不响应的比例显著高于其他三阴性乳腺癌病人,提示NOD1、ETBF可能作为三阴性乳腺癌新辅助化疗耐药的分子标志物。
ETBF主要通过分泌毒蛋白BFT-1发挥促进乳腺癌恶性进展的作用,其中BFT-1是BFT的主要亚型。经过ETBF感染或BFT-1处理后,肿瘤细胞的化疗耐药和干性均显著增加,而敲低NOD1之后,由ETBF或BFT-1引起的化疗耐药和干性增强的现象得到回复,表明NOD1可能是BFT-1发挥作用的关键分子。利用免疫荧光和GST-pull down实验,作者证实NOD1可以与BFT-1直接结合。机制上,作者发现NOD1可以与NUMB相关激酶GAK结合,通过GAK促进NOTCH信号通路的重要抑制蛋白NUMB降解,进而激活NOTCH-HEY1信号通路。
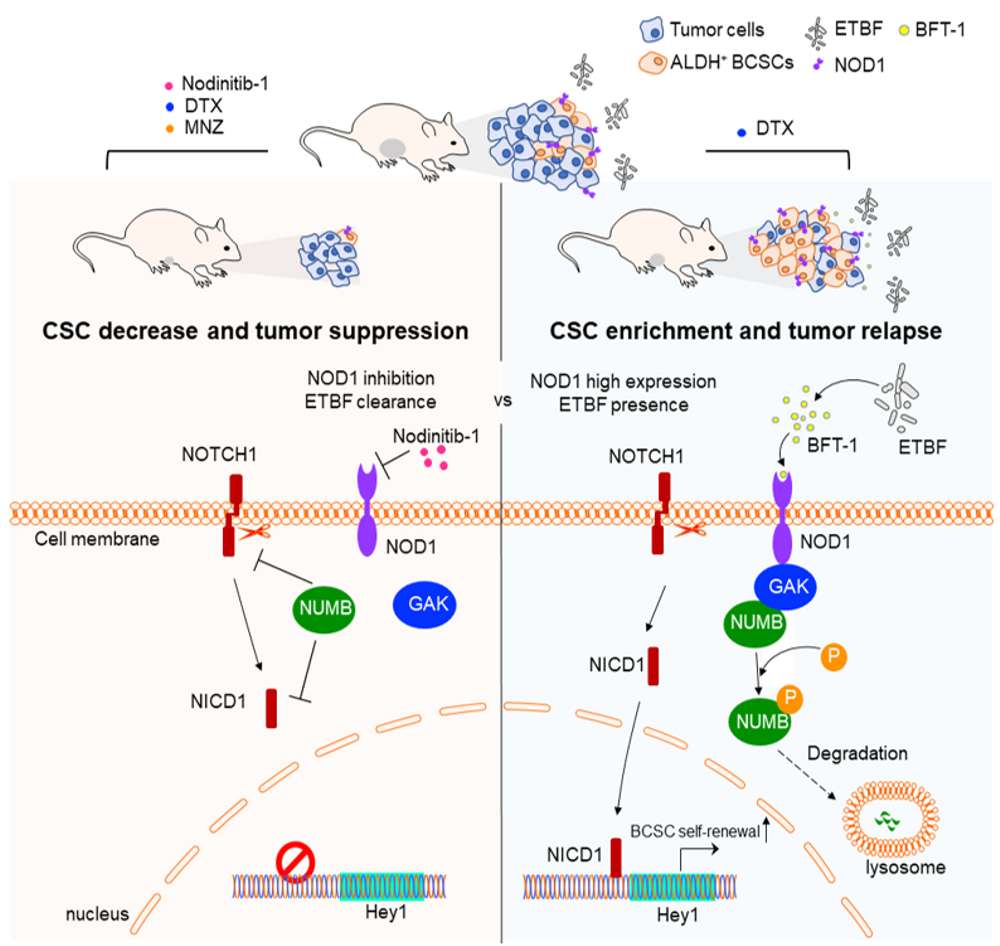
由于乳腺肿瘤细胞的高度异质性和肿瘤微环境的复杂性,当前化疗、单独靶向、联合靶向或靶向联合免疫治疗疗效仍存在矛盾和不确定性。本研究从肿瘤干细胞和乳腺肿瘤组织驻留的肠道菌群两个角度,解析导致乳腺癌多西他赛耐药的关键菌群并揭示其中的ETBF通过关键功能性受体NOD1介导多西他赛耐药的信号网络和分子机制。提出NOD1+ETBF+三阴性乳腺癌病人新辅助化疗效果不佳,而甲硝唑与NOD1抑制剂联合使用,将显著提高多西他赛化疗疗效。这些研究结果为解析肠道菌群调控乳腺癌化疗响应提供理论依据。
原文链接:https://doi.org/10.1093/procel/pwae005




