
多囊卵巢综合征(PCOS)是育龄期女性高发的一种内分泌及代谢紊乱疾病,其典型表征为高雄激素血症、稀发排卵及卵巢多囊样改变,常常伴随胰岛素抵抗、肥胖和2型糖尿病等。由于该病病因复杂且异质性强,其具体的发病机制仍不清楚。2025年11月19日,复旦大学附属妇产科医院黄荷凤院士团队在Signal Transduction and Targeted Therapy上在线发表了题为“PKM2-mediated Histone Lactylation Alters Three-dimensional Genomic Architecture in Polycystic Ovary Syndrome”的研究成果。该研究首次指出,在PCOS中,代谢关键分子丙酮酸激酶PKM2作为细胞核内重要的调节因子,诱发乳酸堆积于细胞核内,促进组蛋白乳酸化修饰,进而驱动染色质三维基因组结构全局性改变,导致多囊卵巢综合征(PCOS)的发生。
该研究通过分析临床PCOS患者血浆代谢组数据发现,高雄激素水平的PCOS乳酸浓度明显高于对照组,同时通过灵敏的乳酸探针进一步证明高雄PCOS卵泡液中乳酸水平明显高于对照组,表明乳酸/乳酸化修饰可能在PCOS卵巢微环境中发挥关键作用。通常,在卵泡发育过程中,颗粒细胞与卵母细胞紧密协作,维持卵泡结构与功能。乳酸作为糖酵解途径的一种关键代谢产物,常被看作细胞无氧呼吸的代谢废物。近年来研究表明,乳酸可作为能源物质、信号分子、糖异生底物等在细胞代谢中发挥重要作用。基于此,团队针对PCOS患者乳酸增加与PCOS发生之间的关联展开了系统的研究。
团队通过蛋白质组学分析证实,PCOS患者乳酸生成过程中的关键酶PKM2显著上调,同时结合孟德尔随机化分析,发现PKM2升高与PCOS风险存在因果关联,提示其可能协同乳酸一起,在PCOS发生中发挥关键作用。为论证PKM2及乳酸在PCOS发生中的可能作用,研究运用乳酸探针、代谢流、RNA-seq及CUT&TAG多种技术证实PKM2可进入细胞核中,驱动组蛋白乳酸化,并通过乳酸-H3K9la和H3K18la组蛋白乳酸化轴,完成PCOS的表观重编程。尤其重要的是,在运用高通量染色质构象捕获技术(Hi-C)分析细胞中A/B区室(compartments)的状态之后,发现PKM2入核后,可影响染色质结构中环的形成和拓扑相关结构域(topologically associating domains, TADs)的边界,从而改变基因表达。具体表现在全基因组维度内,4546个B区室(抑制区域)在7.05%的基因组中转变为A区室(激活区域),而只有少数A区室(1707个)转变为B区室,覆盖了2.65%的基因组。PKM2入核后,指示区室状态的特征向量得分在上调基因区域表现更高。此外,团队还绘制了B-to-A区室开关区域的H3K9la和H3K18la信号图谱,并在PKM2入核后的细胞中观察到更强的H3K9la信号,表明H3K91a有助于活跃的染色质状态。针对核内PKM2影响TADs形成的分析,发现核内PKM2可通过削弱TADs边界CTCF绝缘、促进H3K9la富集,引发TADs融合与短距离环路(short range loops)增加,促进CYP17A1等PCOS关键基因启动子与远端增强子环形成,并伴随H3K9/18la水平升高,驱动雄激素合成增加,形成“雄激素→核PKM2→乳酸化-3D基因组重构→雄激素”正反馈轴。值得一提的是,该研究还发现PKM2小分子抑制剂TEPP-46可逆转DHEA诱导的PCOS样小鼠的囊肿卵泡、高雄激素、动情紊乱及代谢异常表型,纠正PKM2介导三维基因组驱动PCOS相关基因表达,更加凸显PKM2作为PCOS潜在治疗靶点和临床转化意义。
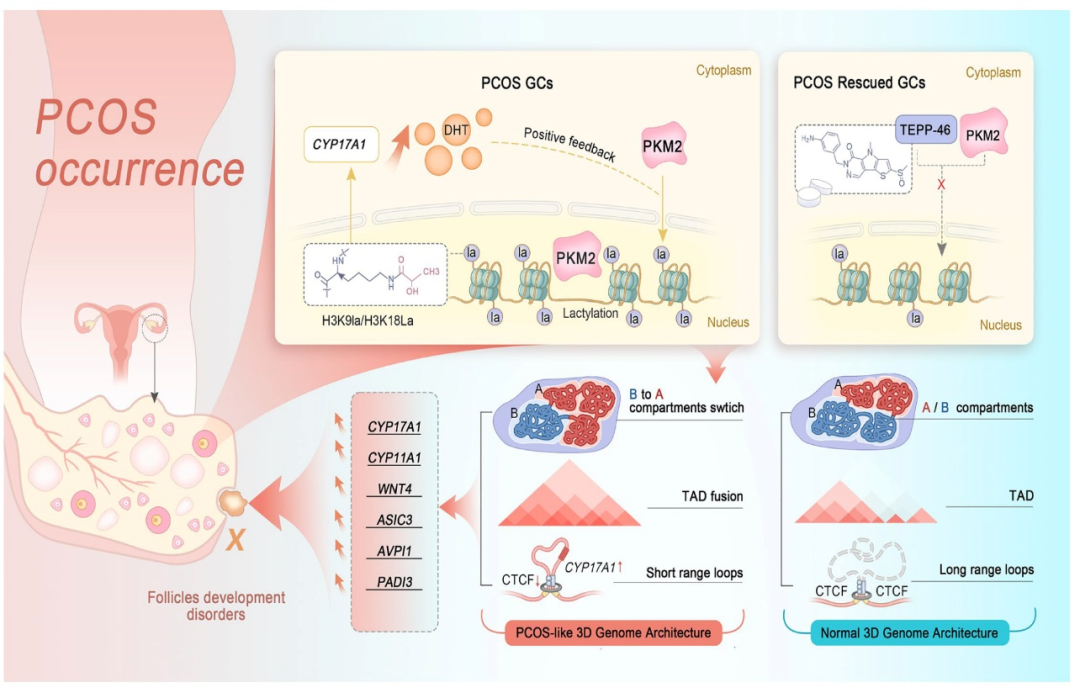
该研究创新地揭示了核内丙酮酸激酶PKM2通过介导组蛋白乳酸化重塑三维基因组结构B到A 区室转换,TADs融合,短距离环路增加,从而驱动多囊卵巢综合征雄激素合成CYP17A1和CYP11A1等相关基因表达,雄激素进一步促进PKM2入核介导组蛋白乳酸化修饰正反馈加剧PCOS恶性循环。研究成果不仅揭示了PCOS中存在着先前不为人知的代谢酶驱动组蛋白乳酸化修饰新机制,还描绘了PCOS疾病中染色体三维基因组结构的全局变化,为临床PCOS的预防和靶向治疗奠定了坚实的理论基础和数据支撑。
黄荷凤院士、复旦大学/生殖与发育研究院杨红波研究员、复旦大学附属妇产科医院/生殖与发育研究院刘欣梅研究员为该论文通讯作者。复旦大学附属妇产科医院/生殖与发育研究院余传金助理研究员、东南大学附属中大医院刘婷婷研究员、复旦大学附属妇产科医院王逸姝医师、东南大学附属中大医院郭星徽博士为该论文共同第一作者。




