SARS-CoV-2持续进化,从Alpha到Omicron再到最近出现的JN.1、KP.2/3,病毒通过RBD区域的频繁突变以逃逸现有疫苗以及抗体的保护作用,给全球带来严重的公共卫生难题。面对上述挑战,需要回答的关键科学问题是:经过多轮疫苗接种与感染后,人体内是否仍能产生可广谱结合不同SARS-CoV-2亚谱系毒株、并对未来突变株保持较好结合效力的anti-RBD单克隆抗体?在SARS-CoV-2的进化历程中,是否依然存在极为保守的RBD表位?
近日,复旦大学基础医学院王乔、香港大学朱轩、复旦大学生命科学学院王鹏飞、复旦大学生物医学研究院孙蕾等团队合作在Nature Communications上发表了题为“Orphan broadly RBD-binding antibodies annotate three remaining conserved RBD epitopes along SARS-CoV-2 evolution”的研究论文。该研究首次系统揭示了SARS-CoV-2突破感染(BTI)或疫苗接种可诱导机体产生靶向SCORE-A、B、C三个超级保守RBD表位(super-conserved RBD epitope,简称SCORE)的广谱结合抗体。这些抗体对SARS-CoV-1、Omicron突变株(如EG.5.1、BA.2.86、JN.1、KP.2/3)乃至其他沙贝病毒均表现出交叉结合与保护活性。这一发现为应对病毒持续变异、开发广谱冠状病毒疫苗和抗体药物提供了重要理论依据和靶点支撑。

研究团队采用了异源双诱饵单B细胞分选策略,以SARS-CoV-1 RBD和XBB RBD作为诱饵蛋白,从疫苗接种或突破感染康复者体内中精准捕获那些稀有的双阳性B细胞。研究团队从上述B细胞中克隆出百余株具有交叉结合活性的单克隆抗体。进一步广谱结合活性以及中和效力检测证实,上述抗体具有极为广谱的体外结合与中和活性,可识别并中和多种SARS-CoV-2突变株(包括新近出现的JN.1等),以及SARS-CoV-2、WIV1以及Pangolin-GD在内的一些沙贝科病毒。
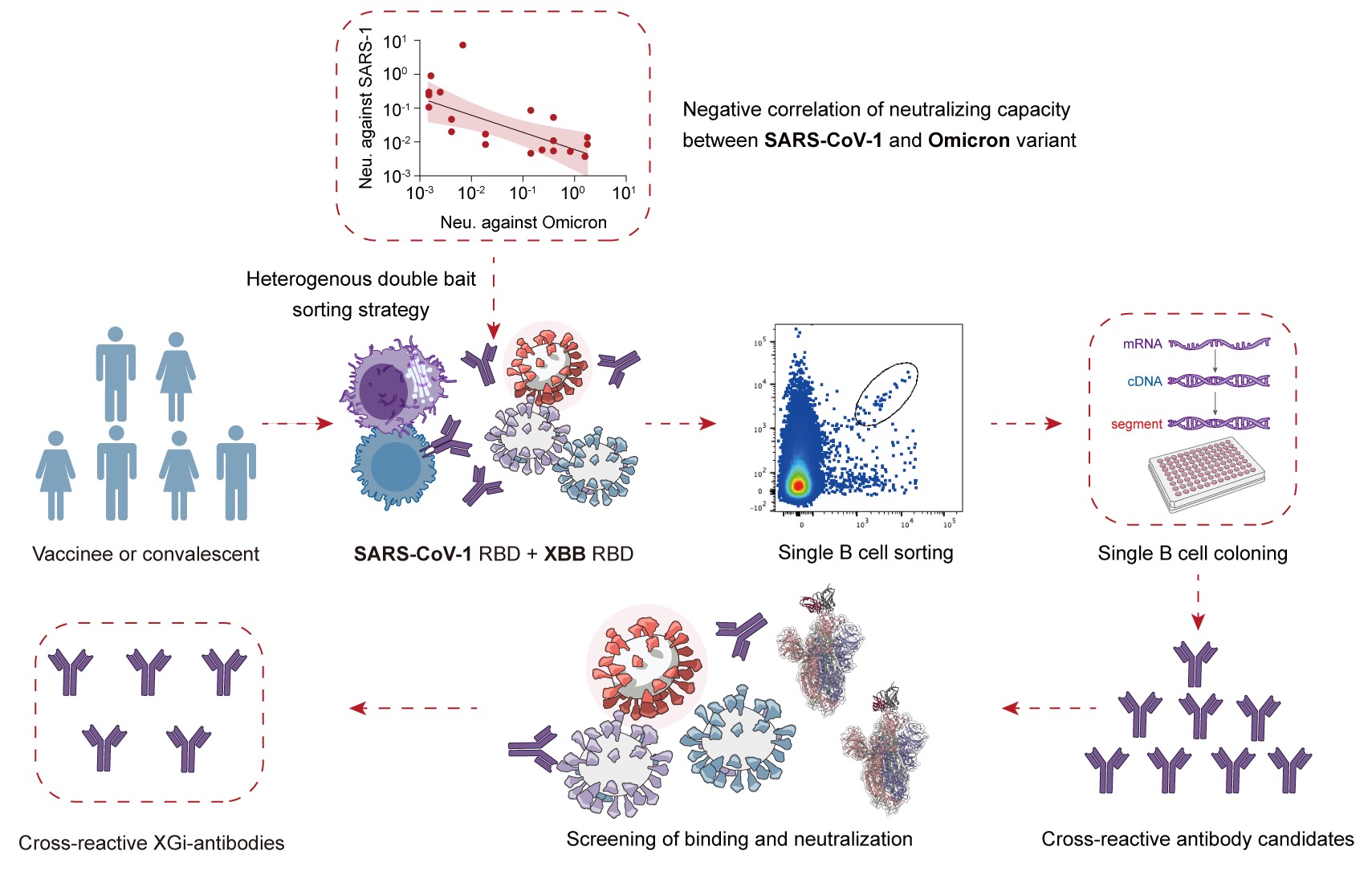
图1 异源双诱饵蛋白分选及广谱抗体筛选
序列比对以及遗传学分析揭示,这些广谱结合抗体具有非克隆扩增的特征,且携带较高水平的体细胞高频突变,是典型的“孤儿抗体”。
通过系统的表位以及结构分析,研究人员成功描绘出三个非重叠的SCORE表位图谱。其中SCORE-A位于RBD侧面,序列高度保守;SCORE-B与ACE2结合区重叠,虽然部分残基发生突变但整体结构保持稳定;SCORE-C则是一个隐匿的表位,具有高度的序列保守性。这三个表位如同病毒的“阿喀琉斯之踵”,在不断的变异压力下依然保持稳定。
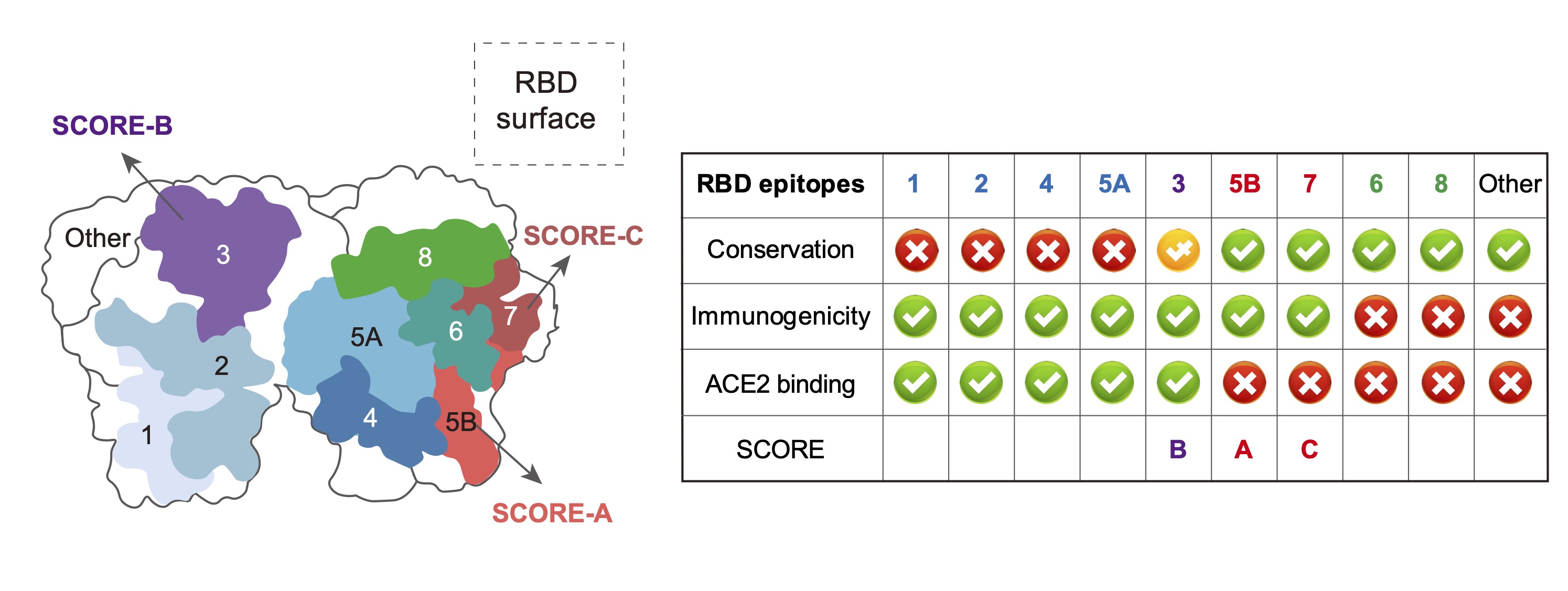
图2 SARS-CoV-2进化历程中,仍有三组超级保守的RBD表位(SCOREs)
此外,研究团队通过仓鼠感染模型验证上述抗体的体内活性,结果显示广谱结合抗体预防性给药能有效降低EG.5.1感染后仓鼠体内病毒载量并减轻肺组织损伤。值得注意的是,即使是中和活性较弱的广谱结合抗体,XGi-183和XGi-203抗体,也展现出一定的保护效果,证实广谱结合抗体以及广谱中和抗体在体内均能提供一定的抗病毒效力。
复旦大学谢敏翔、邱译侬、赵晓宇、张青松、李嘉言;香港大学史佳璐、刘妧晨;上海市宝山区疾控中心何佳滢为本文共同第一作者。复旦大学王乔研究员、王鹏飞教授、孙蕾研究员、吴凡研究员、夏荣教授以及香港大学朱轩教授为本文共同通讯作者。本研究获得国家重点研发计划、国家自然科学基金和上海市科技重大专项“重大突发传染病防控关键核心技术研究”等项目的资助。
原文链接:https://www.nature.com/articles/s41467-025-65596-0




