大约60%~80%癌症患者确诊时已处于中晚期,其异质性强、肿瘤微环境高度免疫抑制,给治疗带来巨大挑战。癌症疫苗虽能激发特异性T细胞免疫,展现出抗肿瘤潜力,但对晚期肿瘤的临床响应率不足10%。因此,晚期肿瘤的治疗耐受是疫苗临床转化的关键瓶颈。阐明晚期肿瘤对癌症疫苗的耐药机制,开发针对性靶向策略,对提升晚期癌症免疫治疗效果至关重要。
2026年1月16日,复旦大学生物医学研究院罗敏/卢智刚团队在Journal for ImmunoTherapy of Cancer发表题为“CD300ld blockade overcomes PMN-MDSC- mediated vaccine resistance in advanced tumors”的论文。该研究发现PMN-MDSCs介导晚期肿瘤对癌症疫苗的耐受,阻断CD300ld可克服这一耐受,为晚期癌症患者提供了一种广谱、具有临床转化潜力的免疫治疗新策略。

研究团队利用前期开发的STING激活型PC7A纳米疫苗1,发现在多种肿瘤模型中,早期接种疫苗表现出高效抗肿瘤活性,但癌症晚期再进行疫苗治疗时疗效显著下降,表明晚期肿瘤对癌症疫苗耐受,与临床响应情况一致。肿瘤微环境分析显示,晚期接种疫苗反而导致PMN-MDSC的肿瘤浸润显著增加,同时这些细胞呈现出更强的免疫抑制活性,提示PMN-MDSC很有可能介导疫苗耐受的产生。
PMN-MDSC是肿瘤微环境中的重要免疫抑制细胞,通过多种机制抑制抗肿瘤免疫反应,与癌症患者不良预后密切相关。团队前期发现一个在PMN-MDSC特异性表达的关键免疫抑制受体CD300ld,在这些细胞的迁移和免疫抑制功能中发挥关键作用2。因此,团队利用敲除CD300ld(KO)或胞外域重组蛋白竞争性阻断(LD-ECD)这两种方式来靶向干预PMN-MDSC,探索其是否能够在晚期肿瘤模型中恢复PC7A癌症疫苗的抗肿瘤活性。结果显示,在CD300ld敲除小鼠中,PC7A疫苗可显著逆转免疫抑制微环境,进而抑制晚期肿瘤生长,40%小鼠生存期延长至45天以上。
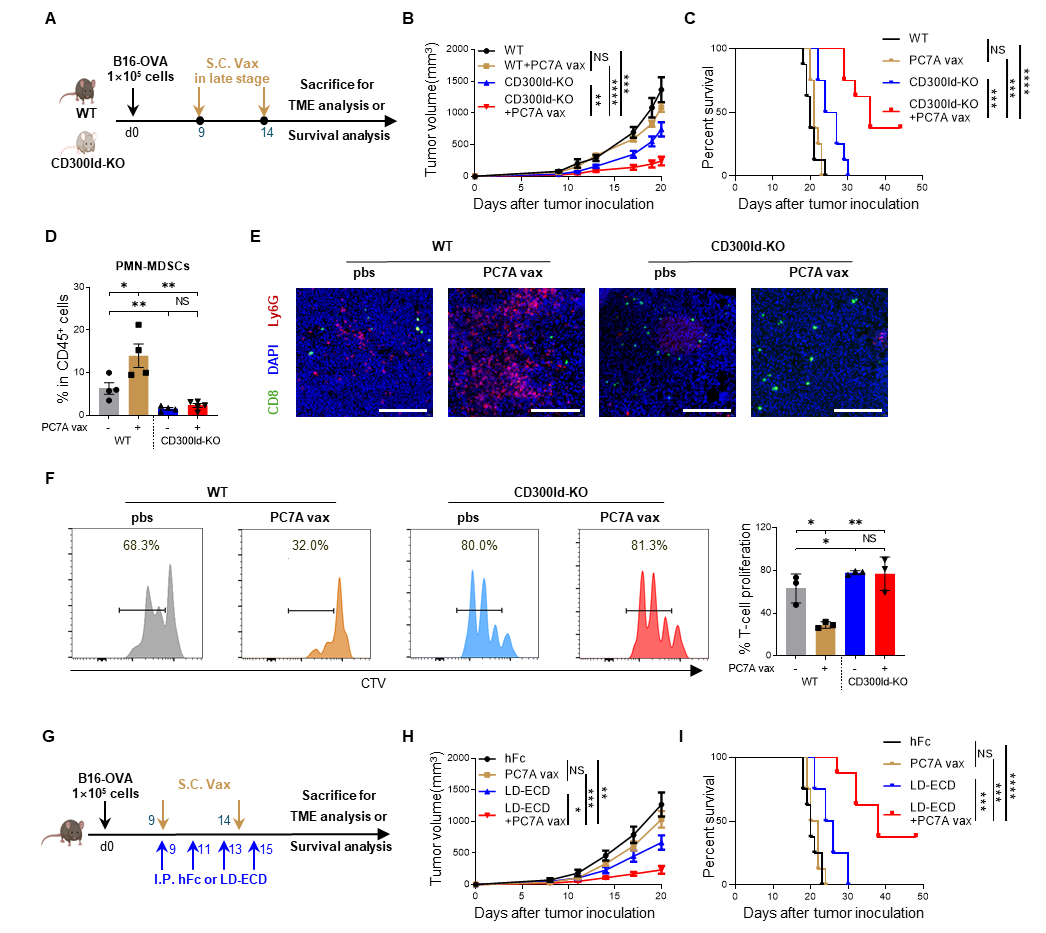
图1. 敲除CD300ld削减中性粒细胞的免疫抑制性,克服对晚期肿瘤对癌症疫苗的耐受
在治疗策略上,LD-ECD竞争性阻断CD300ld,显著恢复了疫苗的治疗效果,且无代偿性骨髓生成等副作用。以上结果表明PMN-MDSC是晚期肿瘤产生疫苗耐受的关键因素。为进一步探索靶向CD300ld逆转疫苗耐受的转化潜能,团队利用CD300ld人源化小鼠开展验证实验,发现产生同样的效果。另外,这种耐受机制和联合治疗策略不仅适用于PC7A纳米疫苗,也适用于FDA批准的poly I:C疫苗,提示该耐受机制具有一定的广谱性,同时提示靶向调控PMN-MDSC具备良好的临床转化前景。
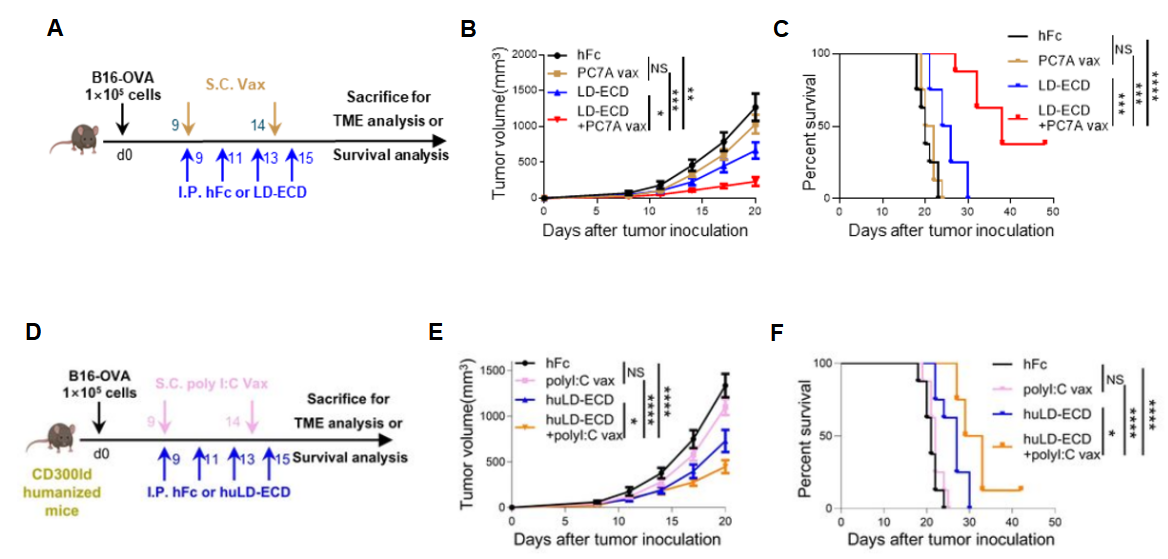
图2. 胞外域重组蛋白竞争性阻断CD300ld联合疫苗策略具有显著疗效
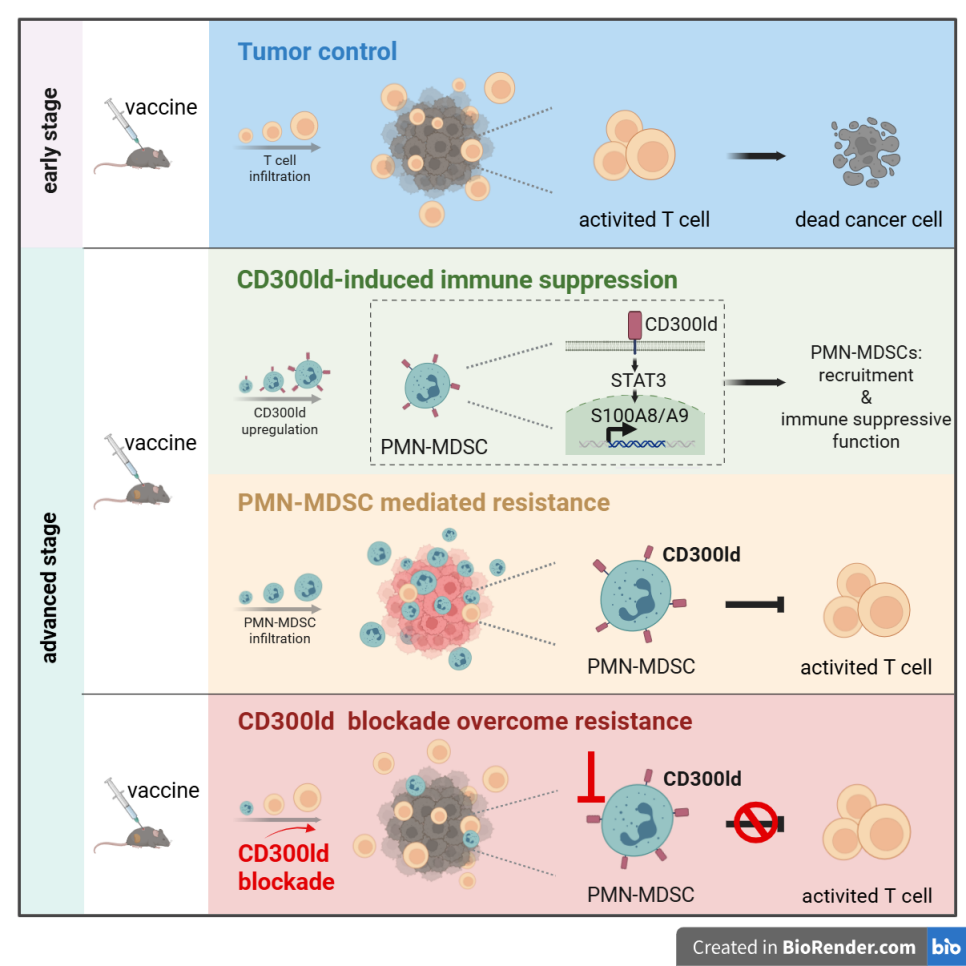
图3. 示意图:阻断CD300ld能够克服晚期肿瘤疫苗耐受
总体而言,该研究揭示了 PMN-MDSC是晚期肿瘤产生疫苗耐受的关键机制,靶向CD300ld来调控PMN-MDSC能够恢复疫苗抗肿瘤效果,为癌症疫苗的临床转化提供了全新靶点和策略。不仅如此,免疫检查点及放疗等一线治疗策略耐受也多次报道有PMN-MDSC的大量浸润3,因此特异靶向这类中性粒细胞,可能为晚期肿瘤的结合治疗方案提供了新的思路和转化策略。
复旦大学生物医学研究院罗敏研究员、卢智刚研究员、李雨薇博士为通讯作者,复旦大学研究生汪想磊、薛诗尧以及博士后李雨薇为文章共同第一作者。该研究得到国家自然科学基金委、科技部项目支持。




