孤独症谱系障碍(autism spectrum disorder,ASD)又称孤独症或自闭症,是以社交功能受损和刻板重复行为为核心症状的一类发育障碍性疾病,影响世界上近1%的人口,成为全球重大公共卫生问题。孤独症患儿通常在婴幼儿早期发病,症状持续终身,绝大部分患者无法独立生活。由于对孤独症核心症状的病理机制缺乏了解,目前尚无有效药物进行临床干预。
近日,复旦大学附属妇产科医院王红艳教授团队与生命科学学院公晓红副教授通过遗传改造的小鼠模型解析病源性突变的致病效应,揭示了孤独症核心症状的分子机制。2022年4月6日,研究成果以“A recurrent SHANK1 mutation implicated in autism spectrum disorder causes autistic-like core behaviors in mice via downregulation of mGluR1-IP3R1-calcium signaling”为题,以Article形式在线发表于Molecular Psychiatry(IF=15.99)。

据报道SHANK基因家族的SHANK2和SHANK3基因与孤独症密切相关,但是SHANK1基因由于其基因敲除小鼠缺乏孤独症样表型而被长期忽视。研究人员对孤独症病例及对照人群进行测序筛查时,发现SHANK1基因编码区在两个独立病例中重复了相同的错义突变c.2621G> A (p.R874H),生物信息学分析和体外细胞实验均显示该突变具有强致病性。为了在体内水平确认并系统研究该突变对孤独症的致病性,研究人员构建了同源突变敲入小鼠模型(Shank1 R882H-KI),且鉴定到社交障碍和刻板重复行为这两个孤独症样核心症状表型。该项研究全面整合模型小鼠行为学评估、神经影像学定位受累脑区、神经元形态及突触结构到相关信号及功能蛋白的分子变化,从不同层次全面阐明孤独症核心症状的重要分子机制。
在敲入小鼠的行为学评估上,研究人员发现Shank1 R882H-KI小鼠模型仅表现孤独症样核心症状即社交障碍和刻板重复行为,而没有焦虑样行为、运动异常或学习和记忆障碍等共患症状,这在ASD相关错义突变KI小鼠模型中是首次发现。考虑到共患症状本身会干扰孤独症样核心症状的评估,Shank1 R882H-KI小鼠无疑是探索孤独症核心症状决定性分子事件的理想模型。
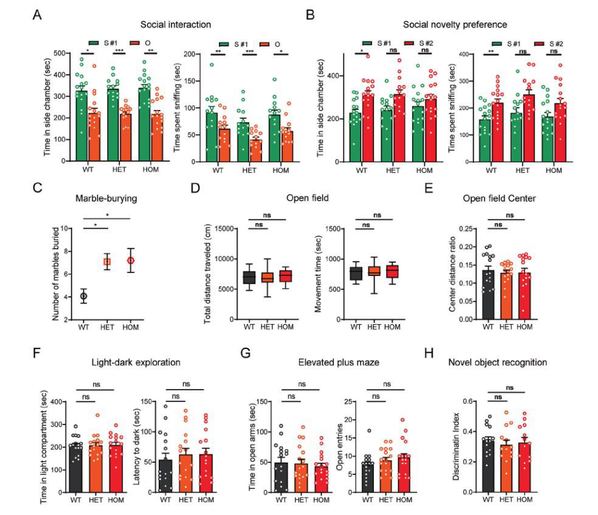
Shank1 R882H-KI小鼠具有社交缺陷和刻板重复行为
继而研究人员借助活体结构磁共振成像锁定了Shank1 R882H-KI小鼠脑结构变化的关键脑区为额叶、海马和小脑。通过定量蛋白质组学和免疫印迹实验分析和验证,发现在这三个关键脑区出现一致性的mGluR1-IP3R1-calcium信号通路的显著下调,其中Homer蛋白为mGluR1受体识别Shank1蛋白所必须,额叶(Homer2)、海马(Homer1)和小脑(Homer3)三个脑区中特异性高表达的Homer蛋白均分别显著下调。既往研究发现并重视离子型谷氨酸受体在孤独症发病中的作用,本研究结果首次明确了代谢型谷氨酸受体-钙信号活性下调是孤独症核心症状的关键分子事件,对孤独症的致病机理理解又迈进一大步。同时敲入小鼠表现出异常的神经细胞结构和功能:树突棘长度和宽度减小,树突棘密度降低,突触后致密区(PSD)形态改变,海马长时程兴奋(LTP)受损、基础兴奋性传递减弱。
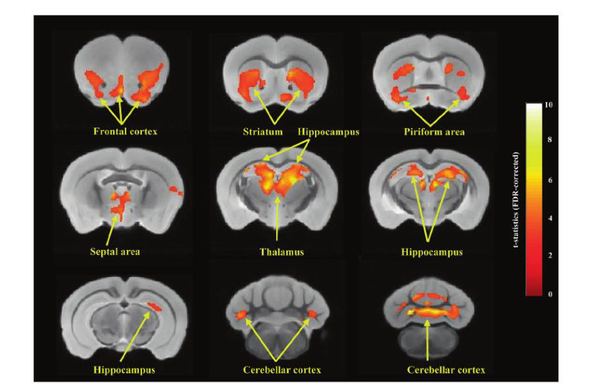
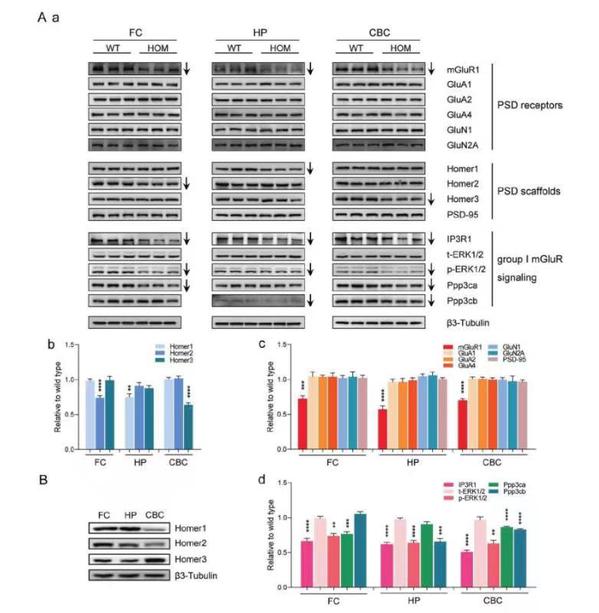
Shank1 R882H-KI小鼠额叶、海马和小脑的mGluR1-IP3R1-calcium通路下调
该研究不仅揭示了mGluR1-IP3R1-calcium信号通路在孤独症的致病机理中发挥关键作用,为针对孤独症核心症状的药物干预提供了潜在靶点。而且,Shank1 R882H-KI小鼠遗传与核心症状的精确对应关系,为孤独症核心症状的精准防控提供了可靠的动物模型。同时,这一人源致病性点突变小鼠模型的疾病表型充分阐明了Shank1基因是重要的孤独症致病基因。
复旦大学附属妇产科医院博士后秦越和上海精神卫生中心杜亚松主任为该论文第一作者,王红艳教授和公晓红副教授为该论文的通讯作者。中科院神经科学研究所仇子龙团队、复旦大学类脑智能科学与技术研究院冯建峰和张孝勇团队、复旦大学脑科学研究院张玉秋团队和杨振纲团队在本研究中给予了重要支持。
原文连接:https://www.nature.com/articles/s41380-022-01539-1




