Hippo信号通路参与肿瘤发生、发展、耐药等不同阶段,是一个理想的肿瘤治疗靶点。近年来,开发靶向Hippo通路的抗癌疗法已成为一个研究热点,但目前尚没有相关药物进入临床。明确Hippo通路调控机制是分子靶向治疗研发的重要基础。然而,Hippo领域近二十年的研究主要聚焦于通路组分的鉴定及功能解析,分子机制研究则相对滞后。
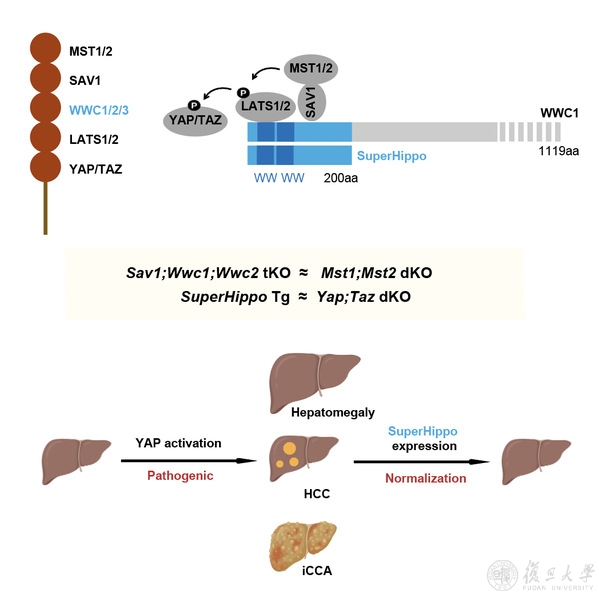
Hippo通路核心部分是一个激酶级联反应:MST1/2激酶(Hippo)— LATS1/2激酶 — YAP/TAZ转录共激活因子。多年来,MST1/2能够磷酸化并激活LATS1/2这一结论被广泛接受,但是MST1/2激活LATS1/2的具体分子机制却很少有人关注。作为整个Hippo通路的枢纽,LATS1/2激酶发挥承上启下的作用,因此明确上游信号调控LATS1/2的分子机制是人为调节Hippo信号强度及研发靶向疗法的前提条件。

2022年4月15日,复旦大学生物医学研究院/复旦大学附属儿科医院余发星课题组在《分子细胞》(Molecular Cell)杂志以长文形式发表了题为“WWC proteins mediate LATS1/2 activation by Hippo kinases and imply a tumor suppression strategy”的研究论文。 该研究揭示了WWC蛋白家族(WWC1/2/3)在MST1/2激活LATS/2过程中的重要功能及分子机制,并基于此机制开发了SuperHippo迷你基因,后者能够特异性激活LATS1/2并显著抑制多种肿瘤的发生。
该研究首次提出了MST1/2-SAV1-WWC1/2/3-LATS1/2信号传递模型(图1)。其中,WWC1/2/3直接同LATS1/2及SAV1结合,SAV1进而招募MST1/2。因此,WWC1/2/3发挥分子平台的作用,将Hippo信号通路核心元件聚集起来,从而提高激酶级联反应的效率。长期以来,WWC家族蛋白被认为是普通的Hippo通路上游调控因子。该研究表明,WWC1/2/3处在Hippo通路的核心地带,也就是MST1/2和LATS1/2之间,起到 一种“卡脖子”功效,其蛋白水平同Hippo通路信号强度高度相关。
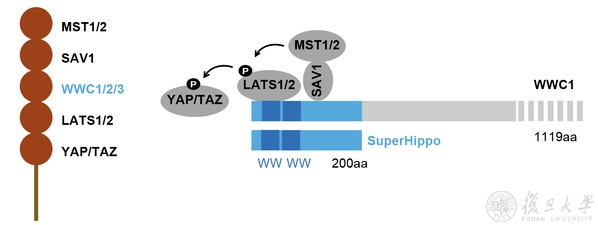
图1. WWC1/2/3介导MST1/2活化LATS1/2的分子机制。
Hippo通路是通过大量的模式动物遗传筛选逐步建立起来的,该通路成员基因的缺失导致细胞过度增殖和器官尺寸增大。然而,不同的Hippo通路基因敲除后,表型强度并不一致。该研究基于分子机制创新,发现小鼠肝脏特异性敲除Sav1及Wwc1/2后,器官尺寸表型强度同Mst1/2敲除相似;另外,这两种基因型小鼠也在相似的时间节点发生了肝细胞癌(HCC)(图2)。Hippo通路从果蝇到哺乳动物进化高度保守,该研究也在果蝇遗传学实验中得到了高度一致的结果。这一系列在体研究,不仅验证了分子机制,同时还发现了首个能够在表型上高度模拟Hippo激酶(Mst1/2)缺失的基因型(Sav1及Wwc1/2共敲除)。

图2. Sav1及Wwc1/2共敲除表型模拟Mst1/2敲除。
WWC家族蛋白同其它Hippo核心组分结合的关键位点集中在其N端(图1)。该研究发现WWC家族蛋白N端200个氨基酸序列能够有效激活LATS1/2。相关迷你基因(命名为SuperHippo)在小鼠肝脏中过表达后,其表型和Yap/Taz(Hippo通路下游效应因子)敲除的小鼠表型十分相似。因此,SuperHippo转基因小鼠也是首个能够表型模拟Yap/Taz缺失的基因型。该研究还从多方面检测了SuperHippo的抗肿瘤功效,发现SuperHippo能够显著抑制YAP/TAZ转录活性,并在多种小鼠肿瘤模型中有效地抑制肿瘤发生发展(图3)。同已知的Hippo通路靶向方案相比,SuperHippo具有以下特色:1)是首个直接激活LATS1/2激酶的分子工具;2)其功能完全依赖MST1/2及SAV1,具有非凡的特异性;3)用途广泛,不仅能够治疗Hippo通路失调导致的肿瘤,对胆管癌、肝细胞癌、葡萄膜黑色素瘤等肿瘤都有一定的效果。
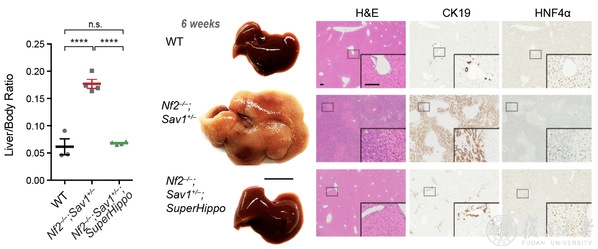
图3. SuperHippo在小鼠遗传模型中抑制肿瘤发生。
总之,该研究不仅揭示了Hippo通路上游核心组分的分子调控机制,还为开发靶向Hippo通路的肿瘤治疗方案提供了全新策略,在基础及转化研究层面都推动了Hippo领域的发展,为后续的研究提供了理论基础及应用工具。据悉,为了严格验证文中的观点,该研究团队运用了大量复杂的敲除细胞、果蝇及小鼠模型。
复旦大学生物医学研究院2017级博士生祁思娴为本论文第一作者,余发星研究员为通讯作者。中国科学院分子细胞科学卓越创新中心张雷研究员,厦门大学周大旺教授及多位复旦大学教授对本文做出了重要贡献。该工作得到了科技部、自然科学基金委、上海市科委研究经费的支持。