流行病学调查,孕期不良环境会影响子代出生结局和远期的健康[1]。黄荷凤研究组2012年在 Diabetes杂志中发现小鼠妊娠糖尿病可能通过表观遗传机制引起子代成年糖尿病[2],提示孕期的健康管理至关重要。然而,育龄妇女孕前期不良内环境是否能影响卵母细胞发育而损害子代健康尚不明确。糖尿病的发生率日趋增高且日益低龄化。全世界范围内有2/5的糖尿病妇女尚在育龄期,且仍有许多病人未得到及时的诊断和治疗[3]。一个亟待回答的问题是:这些育龄期妇女孕前期经历的高血糖等不良内环境能否通过卵母细胞进而损害其子代健康?其机制是什么?
2022年5月19日,Nature在线发表了主要由黄荷凤教授与徐国良教授领衔,由浙江大学、复旦大学、中科院上海生命科学院与交通大学等多家单位合作完成的研究工作的最新研究成果“Maternal inheritance of glucose intolerance via oocyte TET3 insufficiency”。该研究揭示了孕前期的高糖环境可诱导卵母细胞中母源效应因子DNA双加氧酶TET3 (tet methylcytosine dioxygenase 3) 表达降低和功能减弱,改变胚胎DNA甲基化谱式,进而引发子代成年后胰岛素分泌相关基因等表达受限,最终导致子代呈现葡萄糖耐受不良。该工作提示卵母细胞TET3的正常功能可决定子代长期健康。
研究人员首先建立了链脲佐菌素(Streptozocin, STZ)诱导的孕前期高血糖小鼠模型,此后利用其卵母细胞在培养皿中进行体外受精,并将发育好的二细胞胚胎移植到正常代孕母鼠体内孕育子代。这种体外受精-胚胎移植(in vitro fertilization-embryo transfer, IVF-ET)系统能够排除孕期和产后环境变量的干扰,保证子代的表型完全来自于孕前期卵母细胞的不良暴露。研究者对孕前高糖小鼠卵母细胞发育而来的子代小鼠进行健康监测,发现其糖代谢受损,葡萄糖耐受能力不足(impaired glucose tolerance),主要表现为胰岛素分泌不足。有趣的是,孕前期高糖处理只能影响子一代小鼠,而在子二代小鼠中并未发现健康问题。

图1. 孕前高糖雌鼠及其子代小鼠模型的建立
为了寻找孕前高糖暴露的卵母细胞介导子代葡萄糖耐量受损的关键分子机制,研究人员对孕前高糖小鼠的MII卵母细胞进行了转录组测序,发现母源效应因子DNA双加氧酶TET3在孕前高糖卵母细胞中表达下降。徐国良研究组曾在2011年 Nature 杂志中揭示了卵细胞来源的母源因子TET3加氧酶主要负责受精卵中父本基因组DNA胞嘧啶甲基的氧化修饰,从而启动DNA的去甲基化和重编程[4]。进一步分析发现,孕前高糖组受精卵的雄原核中TET3蛋白水平降低,相应的氧化产物5hmC减少。
随后,研究人员对孕前高糖小鼠的子代胰岛进行了全基因组甲基化测序。结果显示,启动子区域高甲基化的基因主要富集在胰岛素分泌通路(insulin secretion pathway)中,其中包括胰岛素分泌的限速酶,即葡萄糖激酶GCK (Glucokinase)。以Gck的启动子区域为例,研究人员发现胰岛素分泌基因的高甲基化最早出现于受精卵的雄原核,并一直延续到子代成年小鼠的胰岛中,并呈现父本特异性的高甲基化。这些结果均提示了在孕前高糖的暴露下,胰岛素分泌基因的高甲基化来源于受精卵的雄原核,且持续到子代。
为了进一步明确子代葡萄糖不耐受的表型和胰岛素分泌相关基因的DNA甲基化谱式的改变是由于卵母细胞中TET3表达的下降引起的,研究人员检测了卵母细胞特异性纯合或杂合敲除Tet3的小鼠子代,发现这些子代小鼠也呈现父源Gck基因的高甲基化与糖耐量受损的表型。此外,在孕前高糖小鼠的MII卵母细胞中回补Tet3 mRNA可以很大程度恢复甲基化水平和子代表型。这些遗传学证据印证了TET3是卵母细胞中介导孕前高糖导致子代血糖代谢受损的重要因子。有趣的是,虽然TET3下调发生于卵母细胞中,反而是受精后的父源基因组Gck启动子甲基化水平出现了更大程度的上升,原因是TET3是一个重要的母源因子,其主要负责受精后的主动去甲基化过程,而该过程有着一定的父源基因组偏好性。
值得注意的是,在生殖中心收取的糖尿病患者的GV期卵母细胞和体外培养的囊胚也分别显示出TET3 mRNA表达降低的趋势和GCK启动子区域高甲基化的状态。这表明小鼠模型中的发现也有重要的临床意义。
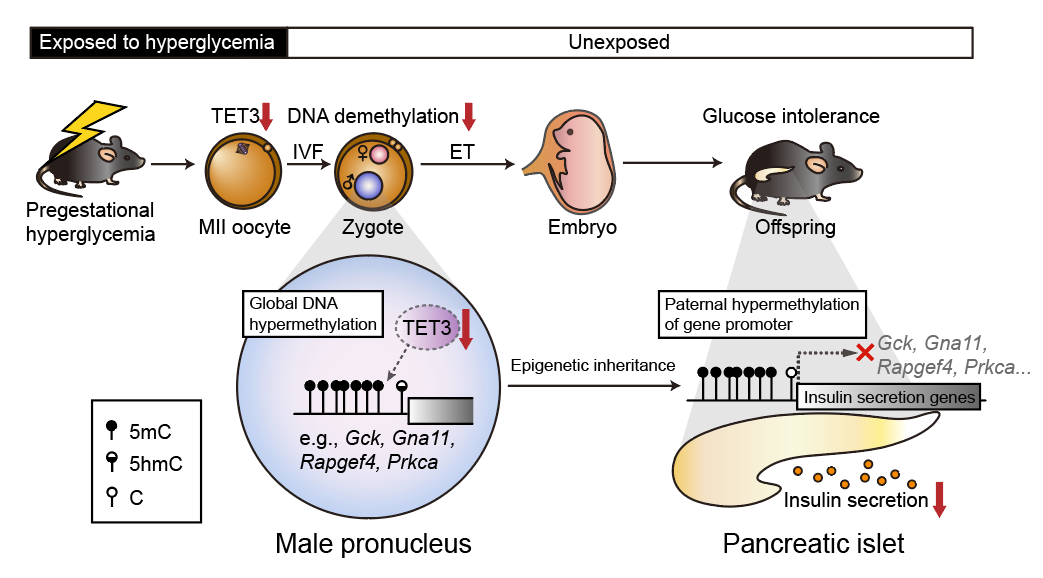
图2. Tet3介导卵母细胞起源性成年疾病的工作模型
综上所述,该研究以孕前高糖环境暴露为例,深入探讨了卵母细胞TET3介导的子代远期糖代谢受损的表观遗传机制,提示了卵母细胞发育时期是一个对环境敏感的窗口期,母源TET3的正常功能作用于父源基因组,进而决定子代健康。该项工作还提示我们:为降低子代出现慢性疾病的风险,将妇女基础疾病的预防和筛查提前到孕前期,可能是预防人群中糖尿病等慢性病的重要策略。该研究拓宽了成人慢性疾病防控和生育管理提供了新思路,并奠定了重要的理论基础。
同期Nature配发了瑞士弗里德希-米斯科舍生物医学研究所Antoine H. F. M. Peters的点评:“本研究发现了一种通过雌性生殖系传递子代表型的新机制,证实了高血糖使得卵子中TET3双加氧酶的表达异常降低,阻碍了受精后对精子来源DNA的氧化去甲基化过程,进而导致了成年后代的代谢受损。”
美国科学院院士Marisa Bartolomei和美国国家生殖表观基因学研究中心主任Wei Yang教授在生殖生物学Biology of Rreproduction杂志上为该Nature文章撰写亮点评论:“该研究不仅建立了妊娠期高血糖症对卵母细胞的表观基因组产生不利影响与后代易患代谢紊乱之间的联系,还揭示了潜在的机制。之前,这一假设从未得到验证,更不用说调节的分子机制了。”
复旦大学生殖与发育研究院、教育部生殖遗传重点实验室黄荷凤院士和中科院分子细胞科学卓越创新中心及复旦大学生物医学研究院的徐国良院士为该论文的共同通讯作者。浙江大学医学院陈宾博士、中科院分子细胞卓越中心杜雅蕊副研究员、复旦大学生殖与发育研究院朱虹博士、中科院分子细胞卓越中心孙美玲博士和博士研究生王超为该文的共同第一作者。该工作还得到了浙江大学医学院盛建中教授、英国阿尔斯特大学Peter R Flatt教授等的大力支持和帮助。
1. Aizer A, Currie J. The intergenerational transmission of inequality: Maternal disadvantage and health at birth. Science 2014, 344(6186): 856-861.
2. Ding GL, Wang FF, et al. Transgenerational Glucose Intolerance With Igf2/H19
Epigenetic Alterations in Mouse Islet Induced by Intrauterine Hyperglycemia. Diabetes 2012, 61:1133-1142
3. federation Id. IDF Diabetes Atlas., 9 edn. International Diabetes Federation: Brussels, Belgium, 2021.
4. Gu TP, Guo F, Yang H, Wu HP, Xu GF, Liu W, et al. The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes. Nature 2011, 477(7366): 606-610.




