耳聋是人类最常见的感官功能致残性疾病,中国聋儿康复研究中心的数据显示,我国听力障碍人群占人口总数16%,约2亿人;患致残性听力障碍,即中度以上听力障碍的人占总人口的5%,约7000万人。我国每年新生3万聋儿,其中60%是遗传因素引起。目前临床上尚无任何药物可用于治疗遗传性耳聋。
7月21日,国际顶尖期刊《科学转化医学》(Science Translational Medicine)在线发表了复旦大学附属眼耳鼻喉科医院舒易来主任、李华伟教授和中科院脑智卓越中心杨辉研究员合作的研究论文“Rescue of autosomal dominant hearing loss by in vivo delivery of mini dCas13X-derived RNA base editor”(基于迷你型dCas13X开发的RNA碱基编辑器治疗常显性遗传性耳聋)。该研究基于新型的RNA编辑工具dCas13X,研发了精准治疗显性遗传性耳聋的前沿技术——针对常见显性遗传性耳聋基因肌球蛋白(MYO6)的RNA单碱基编辑器(mxABE),成功改善了动物模型的听力。这是国际上首个基于RNA单碱基编辑技术成功精准治疗显性遗传性耳聋的研究,为耳聋的精准治疗以及安全的临床转化提供了有力的科学证据。

一般来说,遗传性疾病是遗传物质DNA异常导致的,但人类的DNA会直接发挥功能,而是先以自己为模板,产生对应的RNA,错误的突变基因会产生错误的RNA,最终导致疾病。针对遗传性疾病的治疗,理论上通过纠正DNA或RNA上的异常突变,进而达到治疗疾病的目的。可编程性的RNA单碱基编辑工具是目前最先进的基因编辑工具之一,在不切割DNA的前提下,安全地将RNA局部出错的地方进行精确“校正”,被称为“基因魔剪”,在疾病治疗的安全性和临床转化方面有很强的优势。但是,既有的RNA单碱基编辑工具较大,导致体内递送困难,因此限制了其在体内疾病治疗上的研究和应用。
该研究合作团队研发了小巧的RNA单碱基编辑系统(mxABE),可在RNA水平上实现高效的精确编辑。本次的研究对象为常见的显性遗传性耳聋基因——肌球蛋白(MYO6),其携带者从儿童时期开始表现出渐进性听力障碍。模拟耳聋患者模型观察到感受声音的毛细胞死亡,以及纤毛形态和电生理功能的异常。本研究通过向耳聋小鼠模型的内耳递送治疗系统,成功实现了突变碱基的精准修复,防治内耳毛细胞的死亡、纠正了静纤毛的退化及电生理功能指标,显著改善了听觉功能,为RNA单碱基编辑系统在遗传性耳聋治疗提供科学依据,为研发安全的耳聋基因治疗药物提供新的选择,有望造福广大耳聋患者,恢复自然听力。
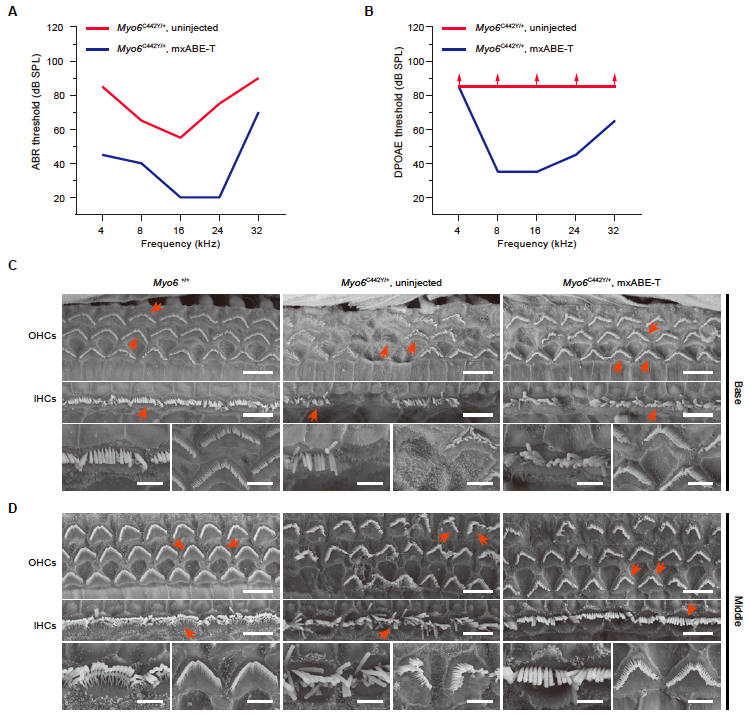
RNA单碱基编辑治疗体系纠正了听力
复旦大学附属眼耳鼻喉科医院舒易来主任、李华伟教授团队长期致力于感音神经性聋的前沿科学创新性探索和临床转化,包括遗传性耳聋基因治疗、听觉保护和临床转化,对显性、隐性和后天性耳聋疾病均已实现了听觉的改善和治疗,针对性地破解目前尚无治疗药物的疑难疾病,以期造福患者。目前多项工作正在进行临床转化。




