复旦大学脑科学研究院/医学神经生物学国家重点实验室杨雄里院士和翁史钧研究员领导的研究小组,近期对自感光视网膜神经节细胞(ipRGC)的研究又取得重要进展,揭示这些细胞参与光照对情绪的调制——强光导致小鼠出现持续性焦虑样行为。论文“Short-term Acute Bright Light Exposure Induces a Prolonged Anxiogenic Effect in Mice via a Retinal ipRGC–CeA Circuit”于2023年3月22日发表于Science Advances(https://www.science.org/doi/10.1126/sciadv.adf4651)。
焦虑症(anxiety disorder)是当前患病率最高的精神疾患,影响全球 7.3% 的人口;而焦虑本身又是一种有益的适应性反应,能促使动物对潜在的威胁保持警觉,提高生存几率。既往的研究显示,光照各种参数(如时程的长短、强度等)的改变会影响人类及实验动物的焦虑水平,且急性的强光处理会促使动物出现焦虑样行为,但其机制尚不明晰。杨雄里院士团队在研究中意外地观察到,在急性施加的强光(1000 lux)照射中止后,小鼠依然表现出长达数十分钟的焦虑样行为。为了阐明其机制,团队针对视网膜不同类型的感光细胞及多个焦虑相关脑区,展开了多学科技术的研究。实验结果显示,特异损毁ipRGC或敲除其特有的感光色素视黑质(melanopsin)完全阻断了上述促焦虑效应,而损毁视杆、视锥这两种常规感光细胞导致的阻断作用微弱。化学遗传学操纵表明:特异压抑中央杏仁核(CeA)的活动,也可阻断上述促焦虑效应,而选择性激活投射至CeA的ipRGC,则显著提升了黑暗中小鼠的焦虑水平。这些结果充分表明,ipRGC—CeA的直接投射环路在上述的持续性焦虑样行为中起了关键作用。此外,药理学及分子生物学实验还显示,皮质酮系统活动水平的提高在其中也扮演了重要角色。这一光促焦虑效应显然在进化上具有特殊意义,使动物不至在强光相关的威胁暂时不可见时立即丧失警觉;然而,鉴于人工强光照明在人类社会生活中的广泛应用,该效应的存在也可能引起 “不必要”的过度焦虑,从而导致病理状况。杨雄里院士团队的这项工作,为研究人类患者病理性焦虑的机制和干预策略提供了新思路。这是该研究小组继最近报道ipRGC在小鼠屈光发育及近视形成中的作用(Liu et al., Sci Adv, 2022)之后,围绕ipRGC研究的又一重要进展,进一步揭示了该类细胞具有多种重要功能,可能是一系列视觉相关的神经精神疾病干预的潜在靶点。
杨雄里院士、翁史钧研究员为该论文共同通讯作者,钟咏梅研究员、张玉秋教授、曹红副研究员等对本工作有重要贡献,博士生王阁为论文的第一作者。
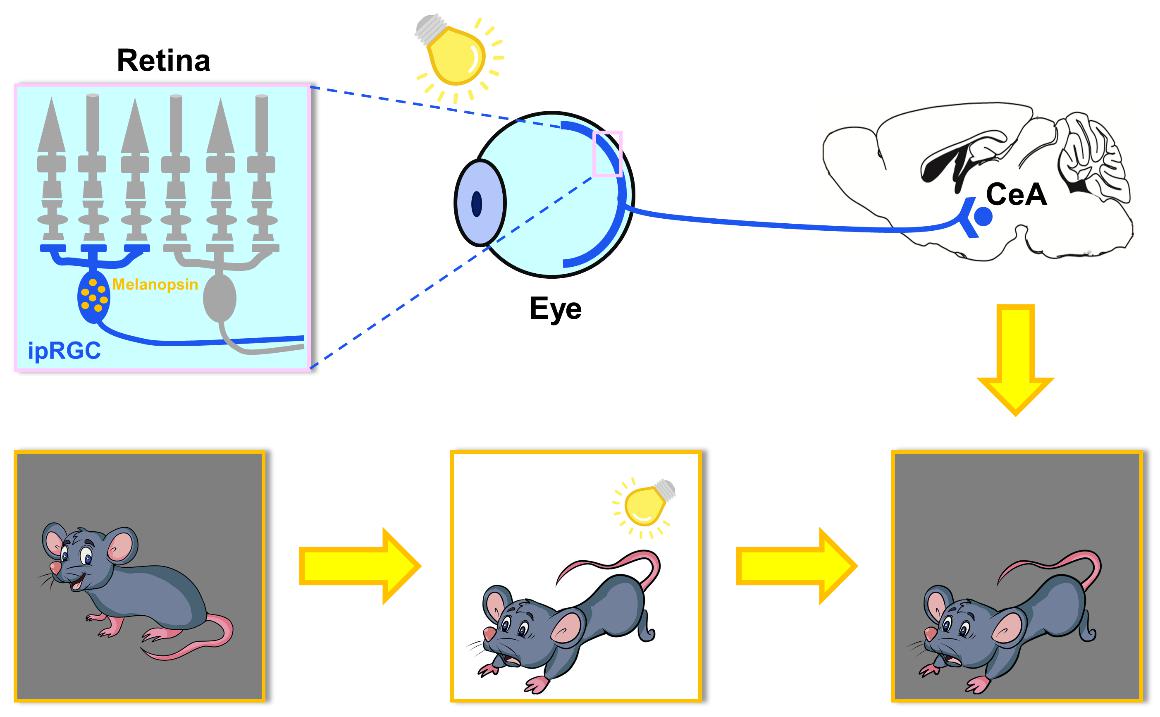
实验主要结论示意图