Hippo信号通路是一条从果蝇到哺乳动物保守的信号通路,在调控器官大小、维持组织稳态过程中发挥重要的作用。Angiomotin(AMOT)家族蛋白是脊椎动物特有的Hippo通路调控元件,以直接结合或促进磷酸化修饰的方式抑制Hippo通路效应分子YAP/TAZ的活性,调控下游基因的表达。除此以外,AMOT家族蛋白可以通过调节细胞极性、细胞连接和细胞迁移,影响血管新生。然而关于AMOT调控血管新生的潜在分子机制尚不清楚,AMOT是否通过调控YAP/TAZ活性对血管新生进行调节,以及Hippo信号通路上游元件是否参与了AMOT对血管的调控仍然知之甚少。
2023年6月23日,复旦大学生物医学研究院/附属儿科医院余发星团队及武汉大学泰康医学院张瑞霖团队在The EMBO Journal杂志以长文形式发表了题为Proteolytic activation of Angiomotin promotes angiogenesis的研究论文。该研究通过大量的生化实验鉴定出了一条全新的AMOT切割活化通路,并从细胞、斑马鱼、小鼠等多个层面全方位验证了AMOT的切割激活在生理及病理性血管新生中的重要功能。

在本工作中,研究人员发现,细胞外的配体如溶血磷脂酸LPA可通过G蛋白耦联受体将细胞外信号传递到细胞内。NF2(Merlin)响应外界刺激,招募多聚二磷酸腺苷核糖聚合酶Tankyrase1/2(TNKS1/2),E3泛素连接酶RNF146及AMOT形成复合物。在TNKS1/2及RNF146的作用下,AMOT先后发生多聚核糖基化及泛素化修饰。带有泛素修饰的AMOT可以被天冬氨酸水解酶DDI2识别,并在第131和132位氨基酸之间发生特异性切割。在内皮细胞中,切割后的C端AMOT(AMOT-CT)可以显著地促进细胞出芽及迁移。
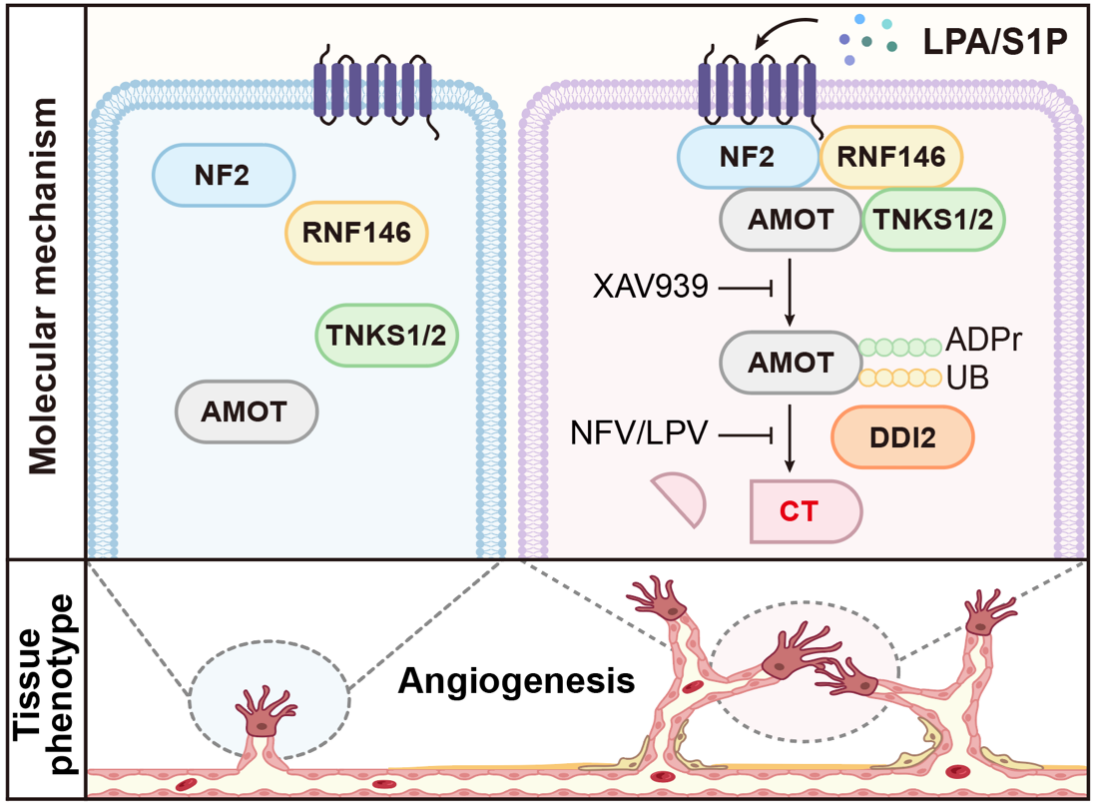
在斑马鱼胚胎血管发育模型中,敲低amot及调控Amot切割的上游因子lpar1/4、tnks1/2、rnf146及ddi2都能抑制血管发育。在amot敲低的斑马鱼胚胎中注射人源全长以及AMOT-CT的mRNA,可以有效地挽救背侧血管缺失的表型,而回补不能发生切割的AMOT突变体则不具有该效应。同时研究人员在ddi2敲低的斑马鱼胚胎中分别回补全长AMOT和AMOT-CT,只有AMOT-CT可以恢复斑马鱼胚胎发育正常。这一系列的实验说明AMOT必须经过蛋白酶的水解加工才具有促血管新生的活性。
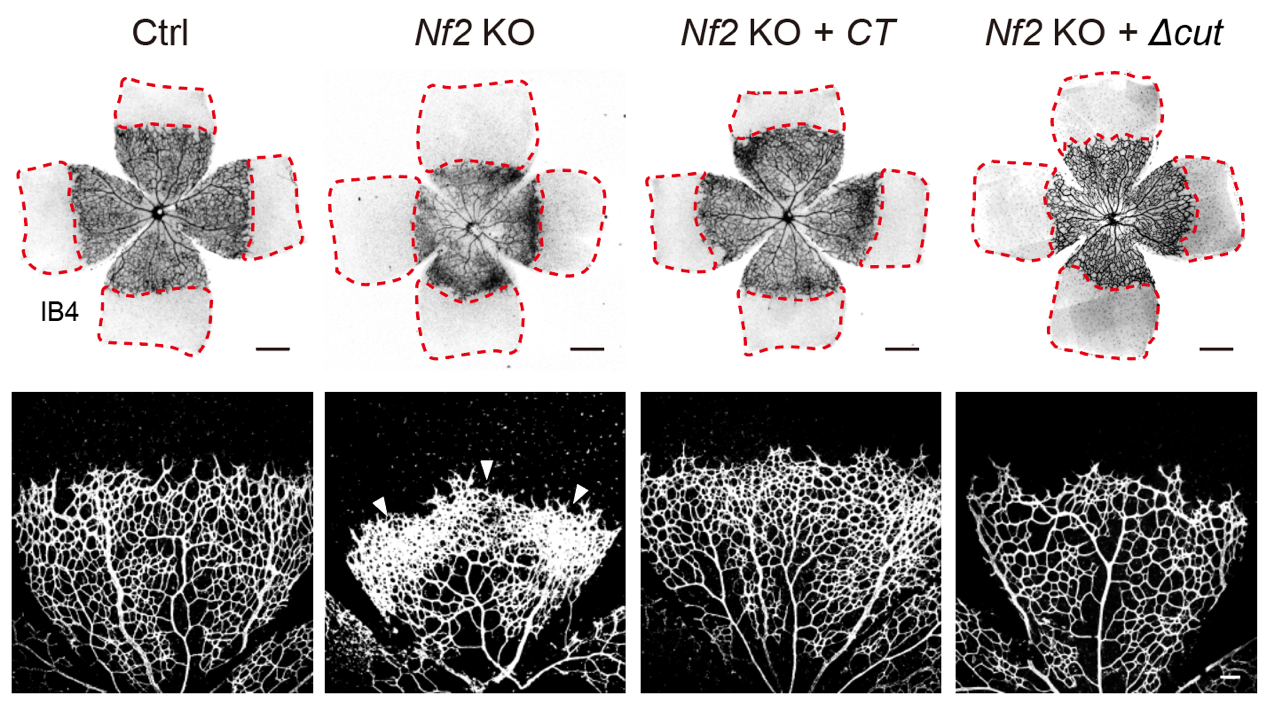
在进一步的研究中,研究人员构建了多达8种、涵盖AMOT切割激活通路多个重要成员的小鼠遗传模型(包括基因敲除/过表达/位点敲入等)。通过分离小鼠视网膜,研究人员对血管发育进行了精细的评估。有趣的是,不能被切割的AMOT不仅不能促进血管的发育,反而起到了明显的抑制作用。切割通路关键成员Nf2或者Ddi2的敲除也显著抑制血管新生,而在此背景下,通过在内皮细胞中特异性表达AMOT-CT,Nf2及Ddi2的敲除导致的血管新生抑制表型可以被有效挽救。
除了研究AMOT切割活化通路在生理性血管新生中的作用,研究人员还在高氧诱导视网膜病变模型(OIR)上,探讨了AMOT-CT在病理性血管新生中的功能。 其中切割位点缺失敲入小鼠视网膜显示出更严重的血管重建缺陷,而AMOT-CT过表达小鼠在OIR模型中则能促进病理性血管新生。
总之,该研究构建了一条以AMOT切割活化为核心的细胞信号转导通路,明确了AMOT切割产物促血管新生的功能,为针对血管新生异常相关疾病的药物研发提供了潜在的靶点。
该工作表明Hippo通路中除了YAP/TAZ调节细胞增殖,AMOT可以作为非经典下游效应分子调节细胞运动及血管新生。同时,全长AMOT抑制血管新生功能,只有切割产物AMOT-CT具有促进血管新生的功能。因此,剖析基因功能不能单一依靠基因敲除实验,需要将生化证据及遗传学表型有机结合,综合分析。
复旦大学生物医学研究院博士后王瑜,博士研究生朱雨闻为本文共同第一作者。复旦大学生物医学研究院/附属儿科医院余发星研究员及武汉大学泰康医学院张瑞霖教授为本文通讯作者。中国科学院上海营养与健康研究所潘巍峻研究员为本研究做出了重要贡献。
文章链接:
https://www.embopress.org/doi/abs/10.15252/embj.2022112900




