2023年9月6日,复旦大学生物医学研究院罗敏/卢智刚/高海合作团队和中国科学院分子细胞科学卓越创新中心赵允团队合作在 Nature杂志在线发表题为CD300ld on neutrophils is required for tumour-driven immune suppression的研究文章。该研究发现一个全新的、功能高度保守的肿瘤免疫抑制受体CD300ld。CD300ld在PMN-MDSCs上特异性高表达,是调控PMN-MDSCs募集及免疫抑制功能的关键受体。靶向CD300ld能够通过抑制 PMN-MDSCs的募集和功能,重塑肿瘤免疫微环境,从而产生广谱抗肿瘤效果。CD300ld靶点显示出很好的安全性、保守性,抗肿瘤有效性、及与PD1 靶点的协同性,有望成为肿瘤免疫治疗新的理想靶点。

以PD-1/PD-L1/CTLA-4等分子为代表的免疫检查点阻断(ICB)疗法是近年来在肿瘤治疗领域中的革命性进展。然而,现有ICB在不同肿瘤病人当中的效果差异很大,相当比例的患者无应答,长期获益比例更低。肿瘤免疫微环境含有大量抑制免疫的髓系细胞群体,在肿瘤发展和治疗耐受中发挥关键作用,是现有免疫治疗的严重阻碍。
病理性激活的中性粒细胞(也被称为多形核髓系来源的抑制细胞:Polymorphonuclear myeloid derived suppressor cells, PMN-MDSCs)是免疫抑制微环境的重要组成细胞。与正常的中性粒细胞不同,PMN-MDSCs具有强烈抑制淋巴细胞杀伤的作用,通过多种途径参与肿瘤进展。寻找针对PMN-MDSCs的特异性靶点来调控肿瘤免疫微环境是当前免疫治疗的焦点和挑战。
作为机体的第一道防线,中性粒细胞在天然免疫中发挥着重要作用,但由于中性粒细胞本身半衰期短且成熟后无法继续增殖的特性,对于此类细胞研究落后于其他先天性和适应性免疫细胞。随着近年来技术的进步,中性粒细胞在生理及病理状态下的复杂性和异质性开始被人们所理解,其在癌症中扮演的角色也越来越受到大家的关注。诸多的临床证据也表明了中性粒细胞深度参与肿瘤进展,并与病人预后显著相关,因此探究中性粒细胞在肿瘤进展中的作用、寻找针对这群细胞的特异性靶点具有十分重要的临床意义。
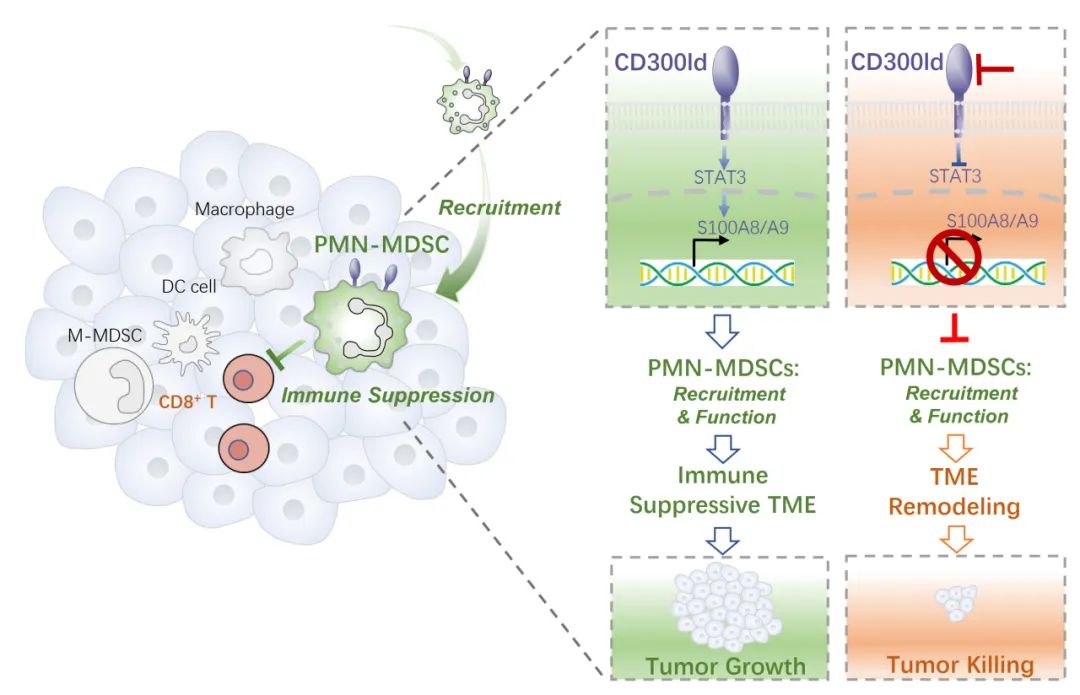
聚焦这一科学问题,本文研究人员首先以髓系细胞偏向表达的系列膜蛋白为对象,利用小鼠肿瘤模型进行CRISPR-Cas9体内筛选,发现缺失CD300ld的免疫细胞在肿瘤中缺失最为显著,提示表达CD300ld的细胞可能促进肿瘤发展。CD300ld在中性粒细胞中特异性高表达、并在荷瘤之后表达显著上调。随后研究者构建CD300ld敲除小鼠,证实CD300ld缺失显著抑制多种继发性及原发性肿瘤模型的发展;同时CD300ld敲除对小鼠的正常发育以及免疫系统发育无显著影响。通过骨髓移植、构建多种条件性敲除小鼠、以及清除体内PMN-MDSCs等多种手段,结果证实CD300ld通过PMN-MDSCs调控肿瘤发展。因此,CD300ld作为中性粒细胞/PMN-MDSCs表面标志物,是PMN-MDSCs促进肿瘤发展的关键功能受体。
为研究CD300ld调控肿瘤免疫的机制,研究者首先分析CD300ld缺失对肿瘤微环境的影响。CD300ld缺失导致PMN-MDSCs在肿瘤中的募集大幅降低,同时伴随CD8+ T细胞浸润显著上升。单细胞转录组分析显示,大部分促肿瘤细胞群体在比例及抑制免疫信号通路上明显下调,而抗肿瘤细胞群体在比例及相应信号通路上则显著上升。因此,CD300ld缺失能够重塑肿瘤免疫微环境,将其由免疫抑制状态转为免疫活化状态。这也进一步体现出PMN-MDSCs在肿瘤免疫微环境建立上的关键作用。
PMN-MDSCs的两个特性是其促进肿瘤进展的关键因素:向肿瘤募集的能力、和高度抑制免疫效应细胞的能力。CD300ld同时调控PMN-MDSCs的这两种功能。CD300ld缺失的PMN-MDSCs表现出更弱的迁移能力和向肿瘤中募集的能力;同时,其抑制T细胞增殖的能力也显著下降。进一步分析表明,S100A8/A9是CD300ld下游的关键效应分子。CD300ld通过激活STAT3,上调S100A8/A9的表达,形成CD300ld-STAT3-S100A8/A9轴,从而调控PMN-MDSCs的募集与免疫抑制功能。
随后研究者探究在肿瘤形成之后再去阻断CD300ld是否仍具有抗肿瘤效果。结果显示,在肿瘤已建成后,利用药物条件性敲除CD300ld仍然能够显著抑制肿瘤发展;研究者进一步通过注射CD300ld胞外区蛋白来竞争性抑制CD300ld,也能够显著抑制各种继发性和原发性肿瘤的进展。阻断CD300ld与PD-1抗体产生更好的联合治疗效果。因此,阻断CD300ld体现出很好的抗肿瘤治疗潜力,并与现有ICB治疗能够产生显著协同。
为进一步研究人CD300ld的同功性,研究者分析了TCGA数据库以及多例不同类型肿瘤的病人样本。结果显示,CD300ld也在人中性粒细胞/PMN-MDSCs上特异性高表达;同时在多种癌种中,CD300LD的表达显著高于癌旁以及正常组织,并与中性粒细胞的浸润以及病人预后显著相关。研究者随后构建CD300LD人源化小鼠,进一步证明人鼠CD300ld功能同源,竞争性抑制人CD300LD也呈现出显著抗肿瘤效果。
综上所述,该项研究发现了PMN-MDSCs表面的关键功能受体CD300ld,在肿瘤免疫抑制中发挥重要作用。CD300ld通过STAT3-S100A8/A9轴同时调控PMN-MDSCs的募集及其T细胞抑制功能,从而促进免疫抑制微环境的建立和肿瘤的进展。阻断CD300ld通过减少PMN-MDSCs的募集并降低其免疫抑制功能,重塑免疫微环境由免疫抑制状态转为活化状态,从而产生广谱抗肿瘤效果。
中国科学院分子细胞科学卓越创新中心博士后王超雄、复旦大学生物医学研究院/附属儿科医院博士后郑曦晨、复旦大学生物医学研究院/附属第五人民医院研究助理张金兰为本文共同第一作者。复旦大学生物医学研究院/附属儿科医院罗敏研究员、中国科学院分子细胞科学卓越创新中心赵允研究员、复旦大学生物医学研究院/附属第五人民医院卢智刚研究员、复旦大学生物医学研究院/附属徐汇中心医院高海研究员为该论文共同通讯作者。
原文链接:https://www.nature.com/articles/s41586-023-06511-9




