2023年11月8日, 复旦大学附属妇产科医院/生殖与发育研究院黄荷凤院士团队在《循环》(Circulation)杂志上发表题为《多囊卵巢综合征增加心血管炎症和缺血性心脏损伤》(Polycystic Ovary Syndrome Fuels Cardiovascular Inflammation and Aggravates Ischemic Cardiac Injury)的研究论文。鉴于近年来年轻女性患者的急性心肌梗死发病率逐年上升的临床问题,本研究团队创新性地提出“多囊卵巢综合征(PCOS)可能存在的慢性炎症状态而增加心血管疾病风险”的假说。本研究通过多种动物模型(包括共生模型)研究发现,PCOS实验鼠存在炎性细胞的骨髓-脾脏-心脏迁移,结合临床PCOS患者的队列研究结果,创新性地提出了PCOS患者心血管病(CVD)高风险发生机制中以慢性炎症为特征的非代谢依赖机制。

多囊卵巢综合征(Polycystic Ovary Syndrome, PCOS)是育龄期女性最常见的生殖内分泌疾病之一,临床表现高度异质性,主要以高雄激素、排卵异常和卵巢多囊样改变为特征,常伴发肥胖、胰岛素抵抗、糖代谢和脂质代谢异常等。以往研究更多地关注PCOS的生殖障碍及其机制。
近年来,女性心血管健康管理成为领域内重要议题,尤其是PCOS与CVD患病风险的相关性受到广泛关注。随着近二十年来年轻女性患者的急性心肌梗死发病率逐年上升,国内外同行提出根据性别特异性的危险因素制定心血管病诊疗指南的必要性。以往研究认为,PCOS患者合并的肥胖、糖脂代谢异常等因素可能是导致CVD风险增加的主要原因,但流行病学研究发现排除这些传统危险因素后,PCOS仍然是CVD的独立风险因素,这一现象提示,PCOS患者心血管疾病易感性可能存在非代谢依赖的原因和机制。
研究人员首先建立了孕期抗缪勒管激素(PAMH)处理的无代谢异常PCOS小鼠,通过心肌转录组测序发现,PCOS小鼠心肌中上调最显著的基因集是炎症反应通路。结合单细胞测序数据,上调的top基因主要为心脏巨噬细胞标记基因,进一步流式细胞实验证实PCOS小鼠心脏中巨噬细胞显著增加。
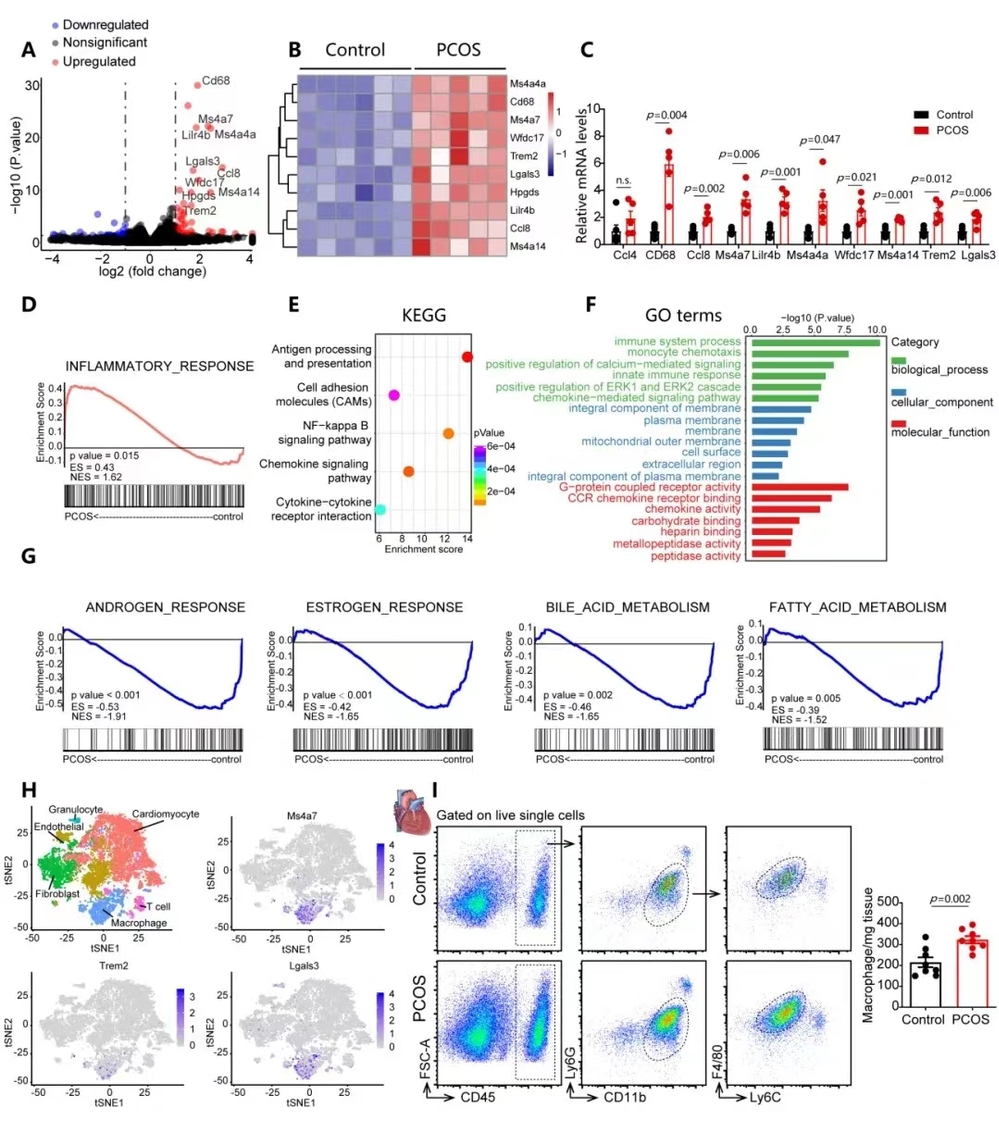
心脏巨噬细胞增多可能来源于心脏驻留巨噬细胞增殖或循环单核细胞分化。为了探究PCOS小鼠心脏巨噬细胞增多来源问题,研究人员分别建立了CD45.1和CD45.2小鼠及ZsGreen+和ZsGreen-小鼠共生模型,予以特异性标记外周血单核细胞,示踪单核细胞来源的心肌巨噬细胞数量,发现PCOS小鼠心脏表现出更高数量的单核细胞衍生巨噬细胞,提示PCOS小鼠心脏巨噬细胞增多来源于外周循环。
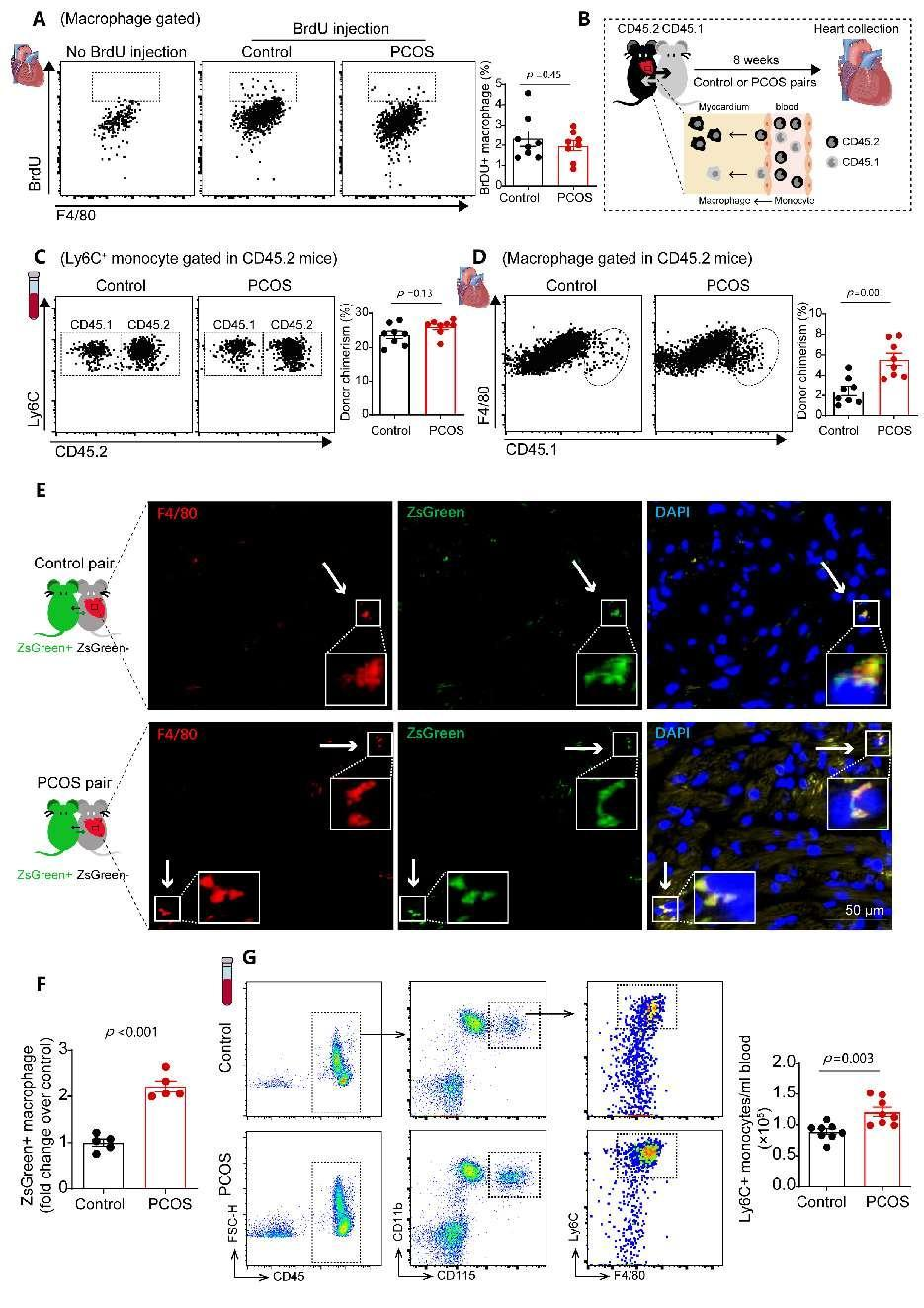
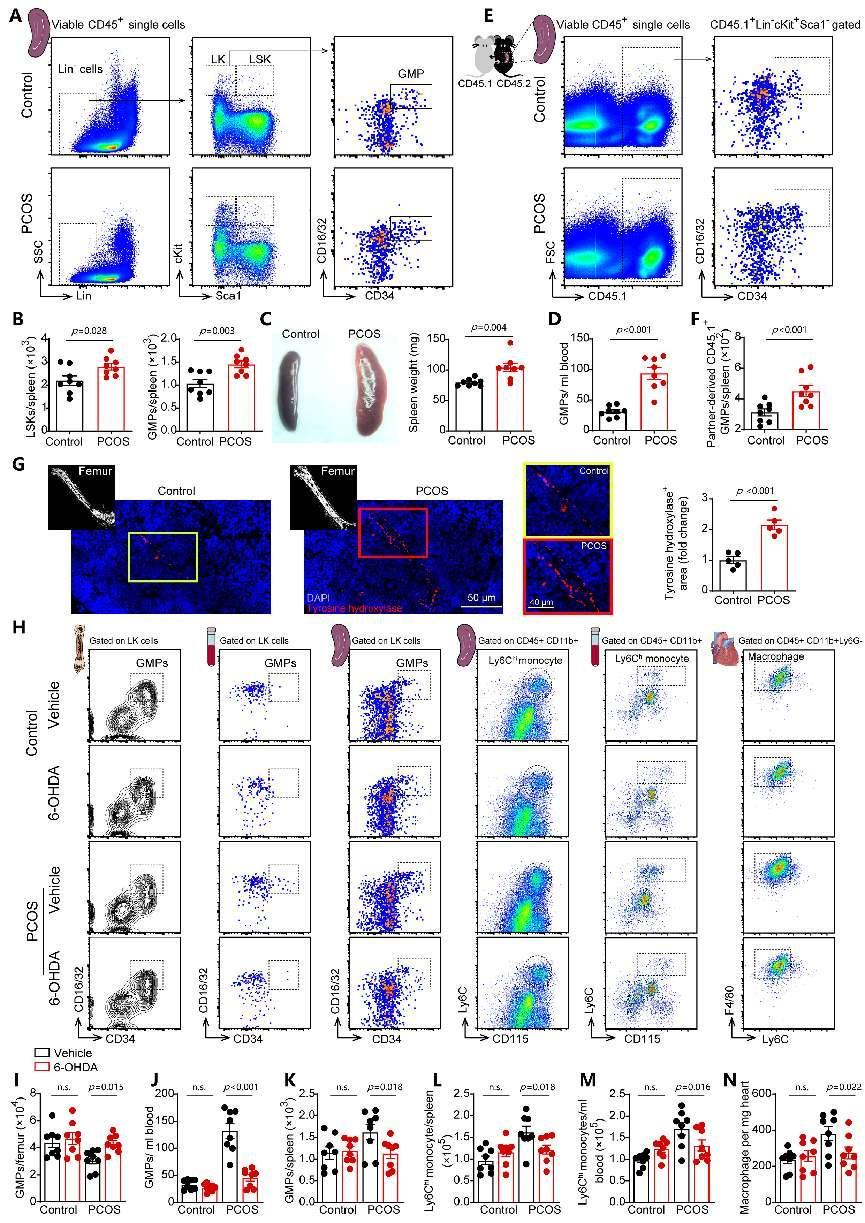
进一步,研究人员探讨了PCOS小鼠循环单核细胞增加的来源。团队发现PCOS小鼠骨髓及脾脏存在着交感活性亢进,其中骨髓交感兴奋会促进骨髓造血干细胞和祖细胞向血中释放,脾脏交感兴奋通过激活NF-kB促进血管细胞粘附分子1(Vcam1)增加,Vcam1的增加促进骨髓来源造血干细胞/祖细胞在脾脏的粘附和驻留,从而促进脾脏单核细胞生成及释放入血增加,介导了心肌和血管巨噬细胞数量累积,导致严重的心血管损伤。当通过6-羟多巴胺(6-OHDA)介导的化学交感神经消融后, 以上表型与对照小鼠趋于接近。以上结果提示PCOS小鼠骨髓交感神经张力的增加促进髓系祖细胞动员至脾脏,增加脾脏单核细胞生成和外周循环单核细胞数量。
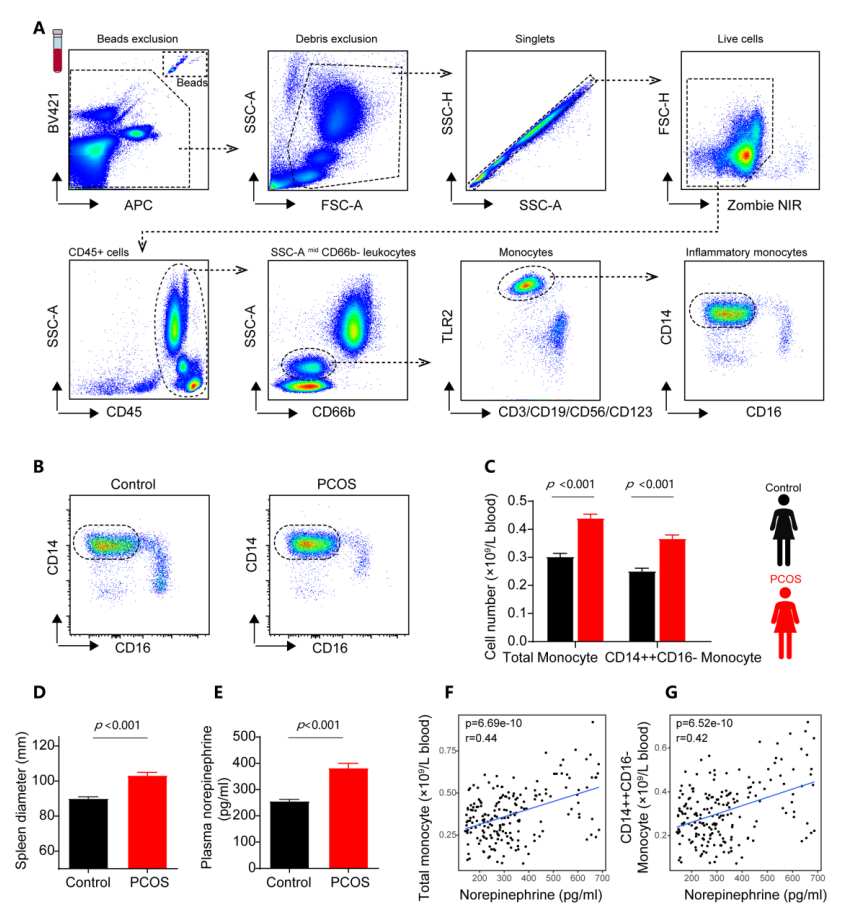
为了证实上述动物研究发现,研究人员利用正常育龄期女性和多囊卵巢综合征患者队列,通过横断面研究比较发现,多囊卵巢综合征患者存在血浆去甲肾上腺素水平和循环炎症细胞(总单核细胞、炎症性单核细胞)数量的增加,提示PCOS患者存在交感神经张力增加及慢性低度炎症状态。
为进一步探索PCOS存在的全身慢性炎症状态对心血管疾病的影响,研究人员利用PCOS小鼠及大鼠模型构建动脉粥样硬化及心肌梗死(MI)模型。结果提示,与对照组相比,PCOS显著促进动脉斑块内炎症浸润负荷,增加斑块面积和发展;PCOS显著增加梗死心肌组织中促炎型单核细胞及巨噬细胞浸润,阻碍心肌修复并恶化心脏功能。
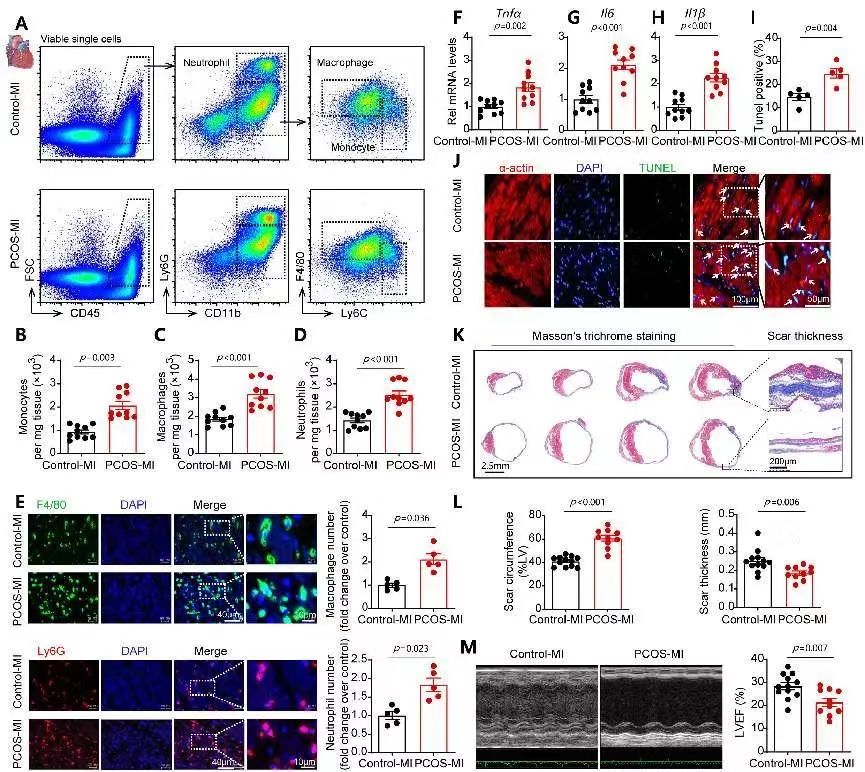
综上,研究人员利用多个物种及特异性基因敲除动物反复验证“PCOS存在的慢性炎症状态增加心血管疾病风险“的假说,创新性地发现PCOS通过促进脾脏单核细胞生成,介导心肌巨噬细胞数量累积,导致更严重的心血管损伤,为PCOS 患者CVD风险增加提供了非代谢依赖的全新机制。上述结果提示在临床实践中, PCOS患者心血管健康的管理除了关注糖脂代谢异常等传统因素外,慢性炎症状态亦应得到重视。

多囊卵巢综合征起源的心血管损伤新机制
复旦大学附属妇产科医院/生殖与发育研究院黄荷凤院士、吴琰婷、金丽教授为该论文共同通讯作者。复旦大学附属妇产科医院/生殖与发育研究院高玲博士、上海交通大学医学院赵怡超博士、浙江大学医学院吴海燕博士为该文的共同第一作者。该工作得到了浙江大学“一带一路”国际医学院盛建中教授的大力支持和帮助。
原文链接:https://www.ahajournals.org/journal/circ
【院士点评】韩雅玲(中国工程院院士)
心血管疾病(CVD)是影响国民生命健康的重大疾病,且渐趋年轻化,降低CVD等慢病发生及过早死亡是国家战略需求。近二十年来,相较于年轻男性,年轻女性患者的急性心肌梗死发病率也在逐年上升,根据性别制定特异性CVD的诊治方案逐渐成为心血管健康管理领域内重要共识。然而,除了目前研究较为深入的传统CVD高风险因素如糖代谢紊乱、脂代谢紊乱、高血压等外,女性CVD存在着特有的风险因素,需要引起重视,其发病机制亟待深入研究。
多囊卵巢综合征(PCOS)是年轻女性患者最常见的生殖内分泌疾病,影响约10%-20%的年轻女性。除了生殖健康外,流行病学研究显示PCOS患者存在更高的CVD风险,PCOS合并冠心病表现更显著的冠状动脉病变,提示PCOS可能是年轻女性CVD攀升的重要原因之一。流行病学研究还发现PCOS是女性CVD发生的独立风险因素;大量的PCOS患者,尤其在我国,并不表现出明显的糖代谢和脂代谢异常。因此,CVD发生风险的非代谢性因素及其发生机制开始受到临床和基础研究领域的重视。
近日生殖医学专家黄荷凤院士团队于Circulation上发表重要研究成果Polycystic Ovary Syndrome Fuels Cardiovascular Inflammation and Aggravates Ischemic Cardiac Injury。该团队基于上述重要临床问题,首先利用临床PCOS队列,发现矫正糖脂代谢等相关混杂因素后,PCOS患者仍呈现(1)血浆中去甲肾上腺素水平升高,(2)循环炎症细胞(总单核细胞、炎症性单核细胞)增高,(3)脾脏体积显著增大,提示PCOS患者存在交感神经激活及慢性低度炎症状态。随后,研究人员构建了无代谢异常的PCOS小鼠模型,证实PCOS小鼠中存在着过度的交感兴奋及髓外单核细胞生成增多,并导致单核细胞在血管及心肌组织中的浸润增加。同时利用多个物种、多种基因敲除鼠及共生模型进行表型及机制研究,发现PCOS患者CVD风险增加的重要机制是慢性炎症反应增加。其主要过程是PCOS交感神经过度兴奋促进脾脏单核细胞生成,介导心肌和血管巨噬细胞数量累积,导致严重的心血管损伤。该过程的发现阐明了PCOS 患者CVD风险增加的以慢性炎症为特征的非代谢依赖机制。
所有疾病机制的研究,都是为治疗提供新的思路和理论基础。黄荷凤院士团队在该研究中创新性地从生殖内分泌临床视角,首次发现卵巢-脾脏-心肌血管对话轴,其功能紊乱是介导PCOS患者心血管风险增加的关键机制,将为年轻女性心血管病的创新干预措施制定提供重要理论依据,有望推动不同于传统心血管保护策略的开发,助力年轻女性患者CVD防控,这些重要的结论将为制定针对性别差异的CVD指南提供非常新颖的观点和重要的依据。




