2024年1月2日,复旦大学基础医学院药理学系,教育部/卫健委/医科院医学分子病毒学重点实验室,上海市病原微生物与感染前沿科学研究基地束敏峰团队在Nature Communications上发表研究论文“Overcoming therapeutic resistance in oncolytic herpes virotherapy by targeting IGF2BP3-induced NETosis in malignant glioma”,揭示了溶瘤病毒耐药的关键分子机理及其干预策略。

恶性胶质瘤(Malignant glioma)是中枢神经系统最常见且最致命的原发性脑肿瘤。目前,胶质瘤患者的标准治疗方案仅限于手术切除和放化疗,中位生存期仅约14个月,预后极差。因此,寻找新的更有效的治疗策略和治疗靶点是胶质瘤临床治疗的迫切需求。
溶瘤病毒疗法(Oncolytic Viral Therapy, OVT)是一种备受关注的新型肿瘤免疫治疗手段。溶瘤病毒(Oncolytic Virus,OVs)除了选择性感染裂解肿瘤细胞的直接溶瘤作用外,还可以介导病毒相关抗原和肿瘤新抗原的释放,最终激活机体抗肿瘤免疫实现杀伤肿瘤的效应。该疗法具有“免疫治疗”“靶向治疗”“基因治疗”三合一的特点,有望成为新一代抗癌利器。 基于I 型单纯疱疹病毒(Herpers Simplex Virus-1, HSV-1)骨架的talimogene laherparepvec (T-VEC; Imlygic) 是第一款被美国FDA批准的用于治疗晚期黑色素瘤的溶瘤病毒药物。在此基础上,溶瘤单疱病毒(oHSV)已被应用于多种肿瘤,因其天然嗜神经性的特点,神经胶质瘤是其理想的肿瘤治疗模型。然而,oHSV的溶瘤活性不足及其耐药性是限制其广泛应用的主要瓶颈,揭示oHSV如何调节肿瘤微环境是阐明其耐药机制以及增强其溶瘤活性的核心所在。
胶质瘤免疫微环境中浸润的免疫细胞主要为髓系细胞,中性粒细胞是其重要组分。中性粒细胞炎性死亡(NETosis)最早于2004年在细菌感染模型中被发现。后续研究发现肿瘤中NETosis发生与病人不良预后密切相关。然而,目前对于中性粒细胞炎性死亡的自身调控机制以及在肿瘤免疫治疗特别是溶瘤病毒疗法中的作用尚不清楚。
m6A即RNA中腺苷酸(A)第六位N上发生的甲基化,是真核生物mRNA中丰度最高的表观转录修饰。IGF2BP3是胰岛素样生长因子-II mRNA结合蛋白(IGF2BPs,包括IGF2BP1/2/3)家族的重要成员,是识别并结合靶RNA的m6A位点的特异性 “reader”。然而,到目前为止,IGF2BP3在胶质瘤免疫微环境的作用和机制尚不清楚。
在这项研究中,研究人员发现恶性胶质瘤中存在着IGF2BP3/MIB1/FTO正反馈信号轴,该轴能够激活m6A介导的CSF3释放,从而诱导NETosis,进而促进胶质瘤的生长。oHSV治疗会进一步激活IGF2BP3/MIB1/FTO轴,同时促进病毒自身复制。然而,这一机制同时也诱导NETosis,最终导致治疗效果降低。
通过单样本基因集富集分析,研究人员观察到神经胶质瘤中IGF2BP3的高丰度表达与浸润性中性粒细胞呈正相关。为了深入研究IGF2BP3对中性粒细胞功能的影响,研究人员建立了三种胶质瘤细胞与不同来源中性粒细胞的体外共培养模型。他们发现IGF2BP3以NETosis依赖的方式促进胶质瘤细胞的生长,而在PAD4-/-小鼠(NETosis缺失)的中性粒细胞中,这种作用被消除。与体外实验一致,IGF2BP3过表达增强了野生型小鼠胶质瘤的生长,而在PAD4-/-小鼠中这种作用显著降低,表明NETosis在IGF2BP3促进肿瘤生长中起着关键作用。
为了深入探究IGF2BP3调控NETosis的机制,研究人员进行了mRNA测序分析,发现IGF2BP3/FTO以m6A依赖方式调控CSF3(中性粒细胞集落刺激因子),同时“reader”IGF2BP3通过调控“eraser”FTO蛋白降解上调了细胞总m6A水平。通过IGF2BP3 RNA测序和FTO质谱的双组学分析,研究人员找到了E3泛素连接酶MIB1。通过后续一系列实验,研究人员发现IGF2BP3/FTO通过m6A途径调控MIB1。体外共培养实验证实了IGF2BP3/MIB1/FTO轴对NETosis的调控作用。
有意思的是,研究人员发现IGF2BP3过表达富集的多条通路与病毒感染相关,其中单纯疱疹病毒感染是最富集的通路。此外,对来自oHSV感染模型的mRNA-seq数据的分析显示,NETosis形成的途径被富集,表明HSV感染与IGF2BP3诱导的NETosis之间存在潜在的关联。后续实验表明,oHSV能够对胶质瘤细胞进行杀伤作用,但会通过上调IGF2BP3诱导NETosis,影响溶瘤病毒治疗效果。因此,研究人员试图寻找一种既能够抑制IGF2BP3表达又能促进oHSV复制的药物。通过一系列药物筛选,最终发现,BET抑制剂JQ1能够显著抑制IGF2BP3诱导的NETosis,并通过将CDK9/RPB-1复合物招募到HSV基因启动子来增强病毒复制。重要的是,该小分子抑制剂被证明能透过血脑屏障,为后续临床试验打下基础(图一)。
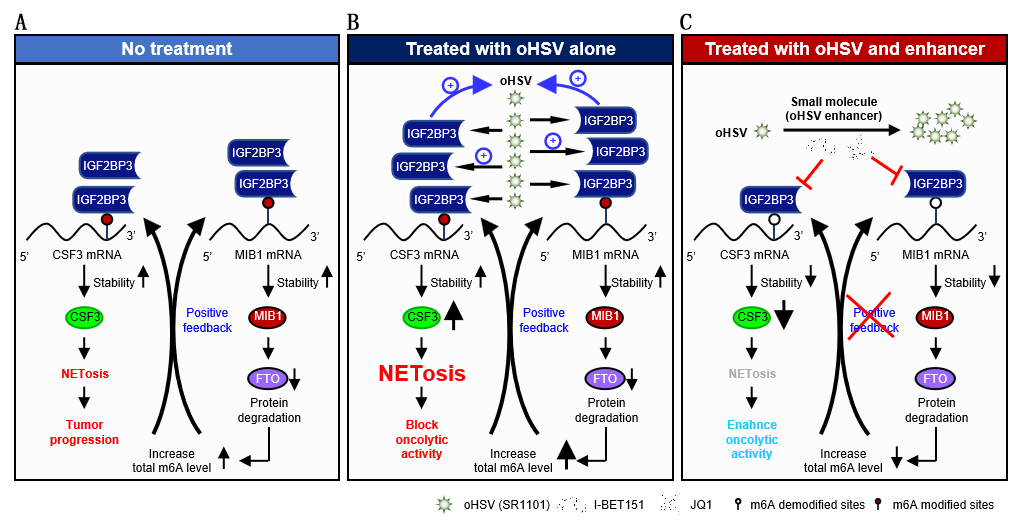
图一:靶向抑制IGF2BP3诱导的NETosis克服恶性胶质瘤对oHSV治疗的耐药性
综上,这项研究揭示了RNA m6A甲基化修饰的 “reader”和 “eraser”之间内在调控关系,阐明了NET形成的表观机理,发现了溶瘤病毒诱导的NETosis是阻碍其溶瘤潜能的关键检查点,并提出靶向NETosis作为克服溶瘤病毒治疗耐药性的全新策略。
该论文的通讯作者为束敏峰(复旦大学基础医学院)和陈菊祥(海军军医大学附属长海医院神经外科),第一作者为复旦大学基础医学院2019级博士研究生代玮玮。这项工作得到了张学敏、李慧艳等专家的支持和帮助。




