慢性疼痛是指持续一个月以上,或反复发作持续三个月以上的疼痛。据国际疼痛研究会统计,全球1/5的人经历过慢性疼痛,“中国疼痛医学发展报告”显示,有超过3亿中国人正在遭受慢性疼痛。临床上慢性痛和抑郁共病现象相当普遍,在患有慢性痛疾病人群中,抑郁症的发病率显著高于正常人群。躯体疼痛和情感上的痛苦交织在一起相互加剧和恶化,使该类疾病的致残率更高、病程更长、预后更差、治疗更为复杂和困难、医疗负担更加沉重。然而,对慢性痛继发抑郁的共病机制研究还相当有限,揭示慢性痛和抑郁共病的神经环路基础对慢性痛及其共病的治疗意义重大。
复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室张玉秋课题组在慢性痛诱发抑郁的神经环路研究中取得重要进展。相关研究成果于2024年1月19日以“Corticotropin-releasing hormone neurons control trigeminal neuralgia-induced anxiodepression via a hippocampus-to-prefrontal circuit(腹侧海马—内侧前额叶通路的CRH神经元调控慢性痛诱发的焦虑和抑郁)”为题发表在《科学进展》(Science Advances)杂志。
本研究采用眶下神经慢性压迫(Chronic constriction injury of infraorbital nerve,CION)方法构建三叉神经病理性痛小鼠模型,发现三叉神经损伤后2周出现明显的焦虑和抑郁样行为表型。与慢性痛继发抑郁样行为出现的时间窗一致,小鼠内侧前额叶皮层(Medial prefrontal cortex,mPFC)V层锥体神经元的兴奋性显著降低,突触前抑制性输入明显增高;与此同时,向mPFC发出投射的腹侧海马CA1区(vCA1)兴奋性锥体神经元的兴奋性明显增强,提示来自vCA1的兴奋性输入通过mPFC抑制性中间神经元控制V层锥体神经元的兴奋性输出。该现象仅发生于CION术后2周,小鼠痛觉敏化和焦虑/抑郁样行为共存期间,CION术后4天小鼠出现明显的痛觉敏化但
伴有焦虑和抑郁样行为时,vCA1锥体神经元和V层mPFC 锥体神经元的兴奋性无明显改变,提示这两个脑区的神经元活动变化与焦虑和抑郁样行为表型密切相关。团队人员进一步操控vCA1—mPFC通路发现,抑制vCA1到mPFC的兴奋性传入在不影响CION小鼠痛觉敏化的基础上显著改善其焦虑和抑郁样行为,提示该投射通路是慢性痛小鼠继发焦虑和抑郁样情绪的关键。对vCA1突触后mPFC神经元的鉴定显示,mPFC内多种类型的抑制性中间神经元接受来自vCA1兴奋性锥体神经元的直接投射,包括一类表达促肾上腺激素释放激素(Corticotropin releasing hormone,CRH)的GABA能神经元。该群神经元在CION术后2周与vCA1之间的兴奋性突触传递显著增强,神经元兴奋性大幅提高;抑制这群CRH神经元或药理学阻断其受体CRHR1显著提高V层mPFC神经元的兴奋性,改善慢性痛小鼠的焦虑和抑郁样行为。
这项研究解析了一条驱动疼痛相关抑郁的神经环路,并揭示了该环路的突触传递和神经调控机制。本研究揭示的神经调质和递质共释放的联动机制,为慢性痛继发抑郁的治疗提供了更为精准的靶点。
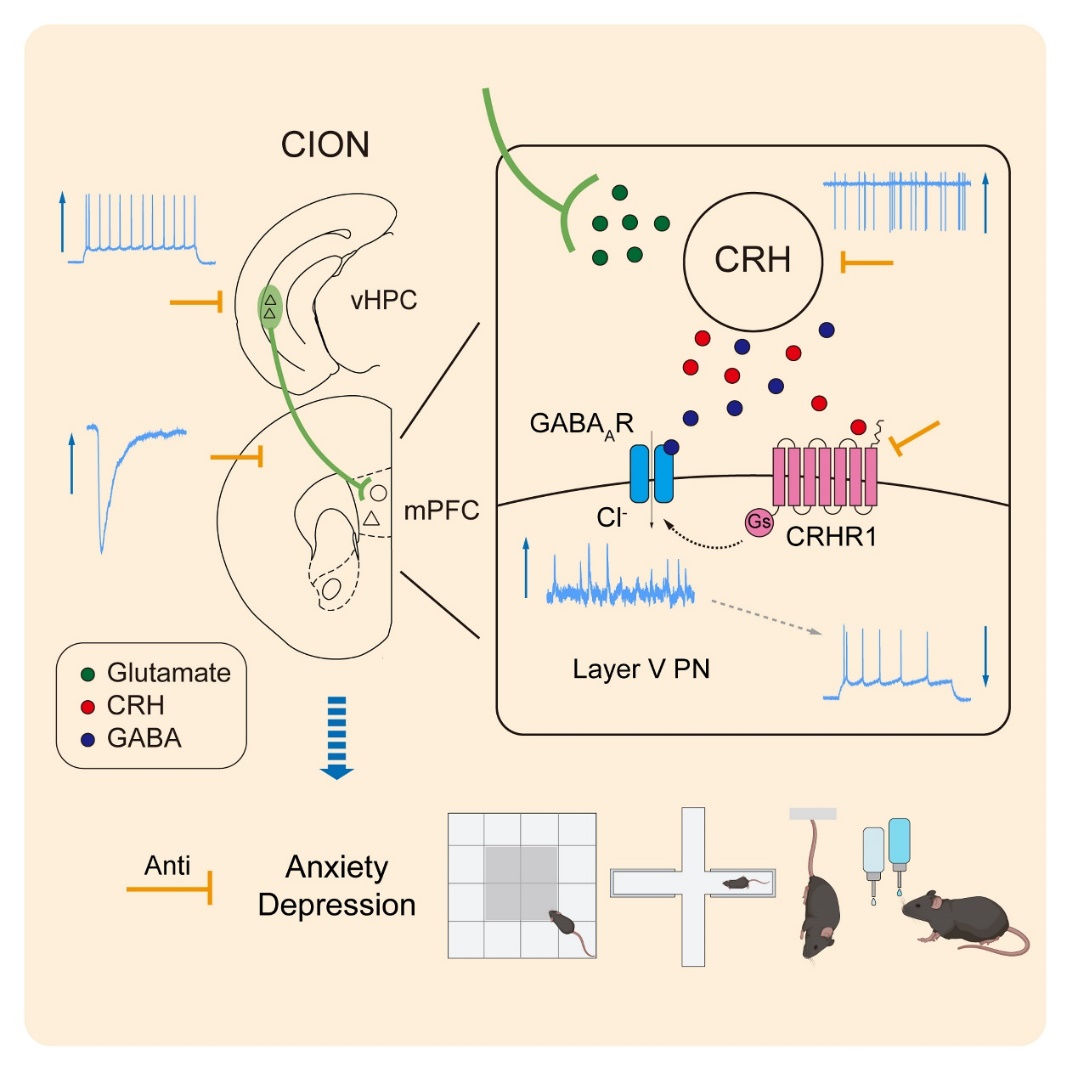
图. vHPCCAMK2A—mPFCCRH投射环路和CRH-CRHR1信号介导慢性痛诱发抑郁的机制
复旦大学脑科学研究院张玉秋课题组博士研究生吕粟粟为本文第一作者, 张玉秋为本文通讯作者。
论文地址:https://www.science.org/doi/10.1126/sciadv.adj4196




