传统地,慢性痛被概念化为依赖于外周炎症和中枢敏化的伤害性活动高度增强的结果。与此对应,对疼痛的研究也主要围绕外周感受器和脊髓初级感觉中枢的痛觉敏化 (外周敏化和脊髓中枢敏化) 机制展开。由此,催生了大量针对离子通道和蛋白激酶等作用靶点的镇痛药开发,然而在临床实践中有良好疗效者相当有限。随着功能脑成像技术的发展和广泛应用,越来越多的证据显示,慢性痛条件下,神经活动增强最明显的并不是传统意义上的“疼痛矩阵”脑区,即介导急性痛 (或生理性痛) 过程的脊髓-丘脑-皮层投射靶区,而是那些与情感、动机、认知评价和负性情绪相关的皮层边缘脑区,如海马、杏仁核和前额叶皮层等。过去十年,神经科学家对皮层边缘环路的结构和功能,特别是神经元特异性投射环路的研究已取得重大进展。然而,对皮层边缘脑区中另一大类细胞,即非神经细胞 (如胶质细胞) 在慢性痛继发焦虑和抑郁的共病机制中所扮演的角色尚不清楚。
2024年1月24日,复旦大学脑科学研究院/脑功能与脑疾病全国重点实验室张玉秋课题组与复旦大学附属华山医院徐文东教授和上海市第九人民医院徐光宙教授合作,在《脑,行为和免疫》(Brain,Behavior,and Immunity)杂志上发表题为《腹侧海马胶质细胞来源的腺苷驱动三叉神经痛继发焦虑和抑郁》(“Glia-derived adenosine in the ventral hippocampus drives pain-related anxiodepression in a mouse model resembling trigeminal neuralgia”)的研究论文,揭示抑制腹侧海马星形胶质细胞和小胶质细胞活化能够降低三叉神经损伤引起的细胞外腺苷水平上调,改善三叉神经痛继发的焦虑和抑郁。
该研究经口内路径结扎三叉神经眶下支构建三叉神经慢性痛小鼠模型,发现三叉神经损伤小鼠术后2周出现典型的焦虑/抑郁样行为,同时伴有腹侧海马 CA1区(vCA1)细胞外ATP和腺苷浓度显著上升,局部给予腺苷受体A2AR拮抗剂DMPX明显缓解小鼠焦虑和抑郁样行为,选择性敲减vCA1脑区CaMK2A阳性的兴奋性锥体神经元表达的A2AR亦可阻止三叉神经痛小鼠焦虑和抑郁样行为的发生。合作团队进一步发现,vCA1脑区增加的细胞外ATP和腺苷主要来源于活化的星形胶质细胞,抑制星形胶质细胞功能或阻断广泛分布在星形胶质细胞的缝隙连接蛋白Cx43明显降低vCA1细胞外ATP和腺苷水平,并有效缓解焦虑和抑郁样情绪。已知释放到细胞外的ATP可迅速在外核苷三磷酸二磷酸水解酶(CD39)和核苷酸酶(CD73)的作用下转化为腺苷。
研究人员观察到,三叉神经损伤小鼠术后2周CD39水平明显上调,且特异性表达在vCA1脑区活化的小胶质细胞,抑制小胶质细胞活化或局部给予CD39抑制剂显著降低细胞外腺苷浓度,改善慢性痛小鼠焦虑和抑郁样行为。此外,活化的小胶质细胞也合成和释放多种促炎性细胞因子,包括白细胞介素17A(1L-17A)。后者通过表达在星形胶质细胞的IL-17A受体,IL-17RA,进一步增加星形胶质细胞释放ATP,进而在小胶质细胞CD39的催化下水解为腺苷。电生理记录显示,三叉神经损伤伴明显焦虑和抑郁样行为表型时,vCA1兴奋性锥体神经元的兴奋性显著增强,阻断腺苷受体A2AR可翻转该效应,提示增加的细胞外腺苷可能通过表达在vCA1兴奋性锥体神经元的A2AR增强其兴奋性活动。一致地,失活星形胶质细胞或小胶质细胞以及抑制CD39活性均可部分地挽救三叉神经损伤引起的vCA1神经元兴奋性改变。
研究表明,慢性痛条件下 vCA1脑区激活的星形胶质细胞和小胶质细胞协同调控细胞外腺苷水平,并通过腺苷受体 A2AR 改变 vCA1 锥体神经元的兴奋性,进而介导慢性痛的焦虑和抑郁样后果。该研究对于揭示慢性痛继发情绪障碍的脑机制和探索治疗两者共病的新靶点都具有重要意义。
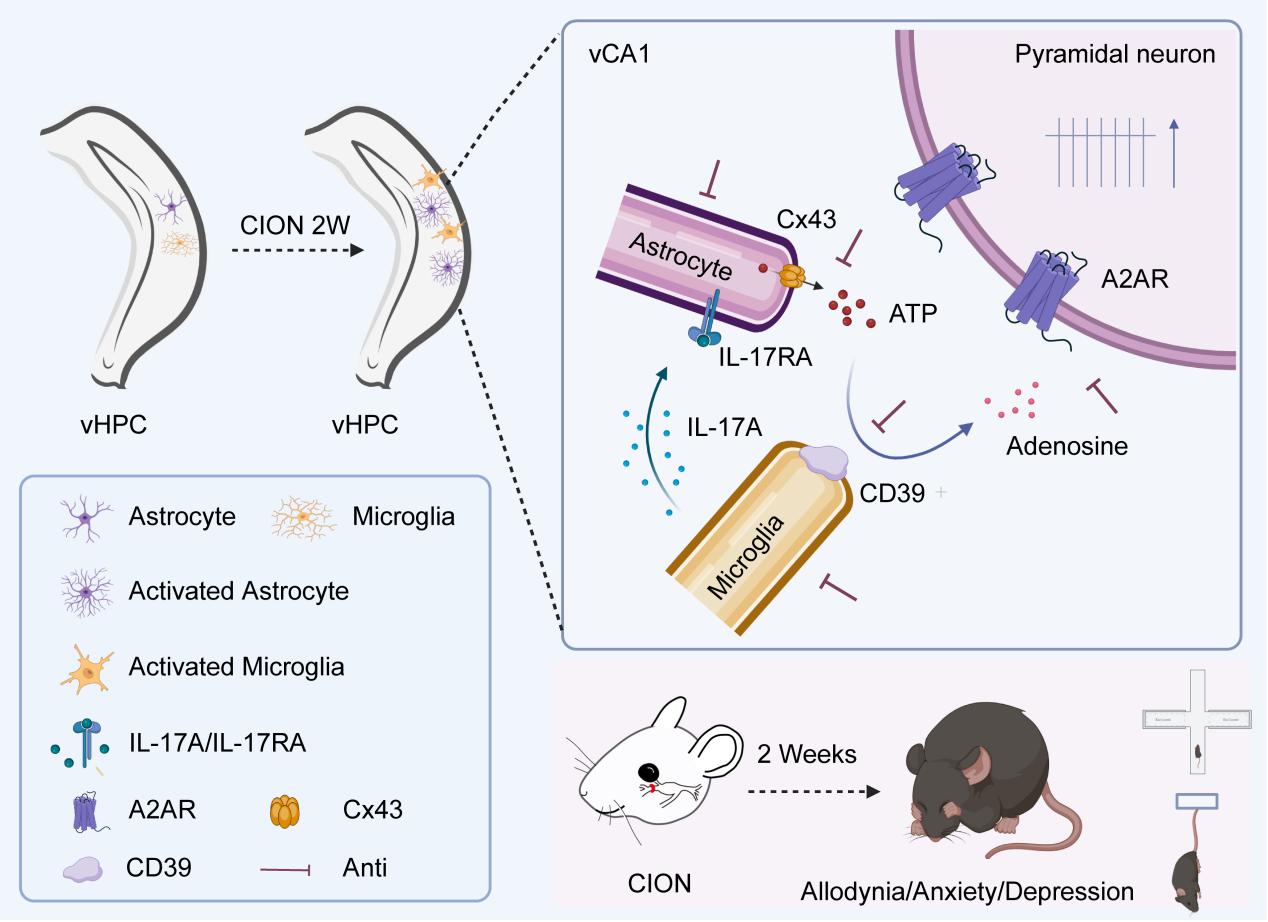
腹侧海马胶质细胞来源的腺苷介导慢性痛继发焦虑和抑郁的机制示意图
张玉秋课题组博士生吕雪静为论文第一作者,张玉秋、徐文东和徐光宙为本论文共同通讯作者。
论文地址:https://doi.org/10.1016/j.bbi.2024.01.012




