2024年2月19日,药学院李清泉教授团队在《细胞代谢》(Cell Metabolism)杂志上发表了题为“Methionine secreted by tumor-associated pericytes supports cancer stem cells in clear cell renal carcinoma”的研究论文。该研究检测确定了一个表达血小板衍生生长因子受体β (PDGFR-β)和G蛋白偶联受体91 (GPR91)的血管周细胞亚群。在透明细胞肾细胞癌(ccRCC)中,该亚群细胞作为癌症干细胞(CSCs)的主要的蛋氨酸来源,促进肿瘤发生和酪氨酸激酶抑制剂(TKIs)的抗性。肿瘤细胞衍生的琥珀酸盐与周细胞上的GPR91结合,激活自噬以产生蛋氨酸。
CSCs利用蛋氨酸在ATPase-family-AAA-domain-containing 2 (ATAD2) mRNA中产生稳定的N6 -甲基腺苷,由此产生的ATAD2蛋白复合物与SRY-box转录因子9组装超级增强子,从而指示其靶基因在CSCs中具有显著特征。特异性GRP91拮抗剂靶向PDGFR-β+GPR91+周细胞,降低瘤内蛋氨酸水平,消除CSCs,增强TKIs敏感性。这些结果揭示了PDGFR-β+GPR91+周细胞为CSCs提供支持生态位的机制,并可用于开发治疗ccRCC的靶点。

周细胞(pericytes)是血管基底膜上的特化细胞,在恶性进展过程中可以获得病理表型以创造促进肿瘤的微环境。例如,周细胞通过分泌促血管生成因子或增加其在肿瘤血管周围的覆盖范围来保护内皮细胞免受抗血管生成治疗的影响。周细胞还通过β3-整合素依赖性旁分泌机制支持癌细胞的生长。因此,消耗周细胞代表了恶性肿瘤的另一种治疗策略。
然而,周细胞是限制肿瘤细胞通过基底膜迁移的屏障的一部分,而消融周细胞已被证明可促进转移。事实上,伊马替尼治疗肿瘤患者的疗效有限,甚至加速了癌症进展,这被认为是由于其在周细胞募集、激活和增殖中的作用。表征周细胞异质性和识别支持恶性进展的亚群可以克服这一障碍。
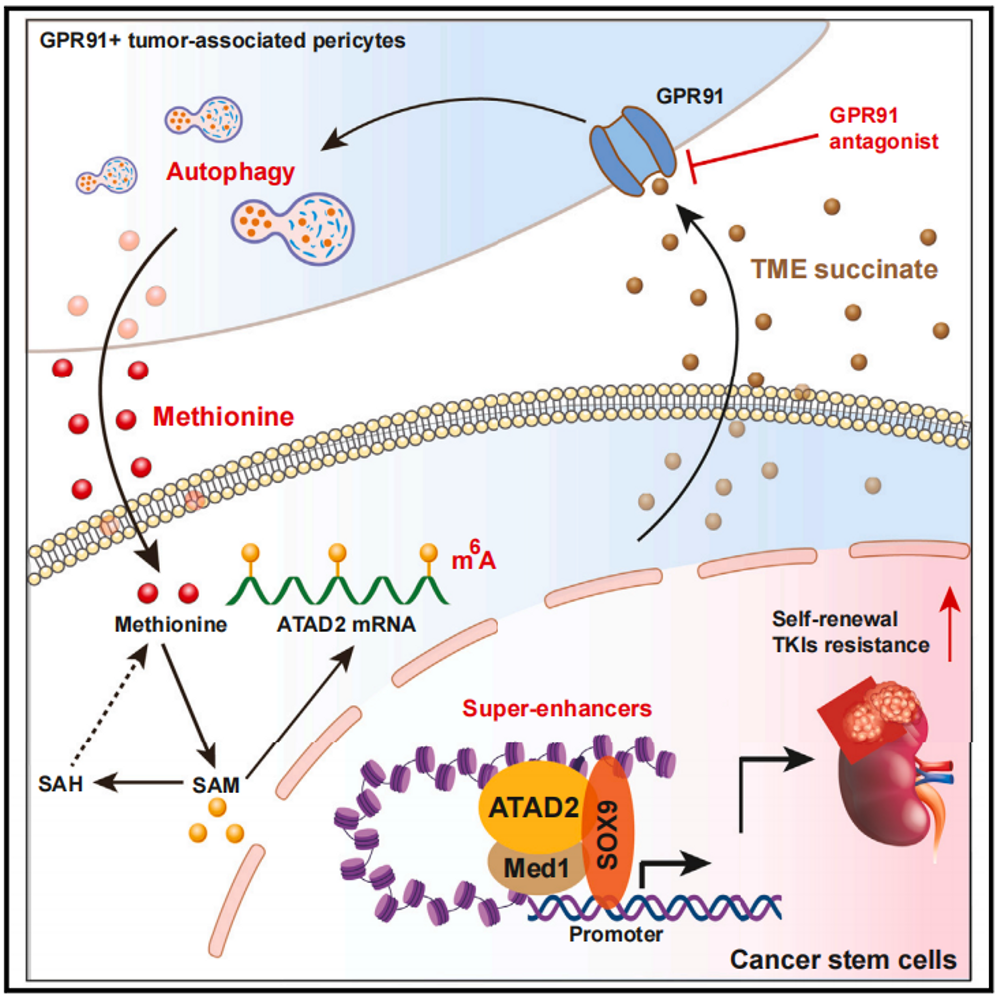
文章模式图(图源自Cell Metabolism )
该研究发现了一个表达PDGFR-β和GPR91的血管周细胞亚群,它们促进透明细胞肾细胞癌(ccRCC)的癌症“干性”,并使它们对酪氨酸激酶抑制剂(TKIs)产生耐药性。在动物模型中,“清理”该周细胞亚群可降低CSCs的频率,抑制肿瘤生长并增加TKI敏感性。这些结果揭示了PDGFR-β+GPR91+周细胞为CSCs提供支持生态位的机制,并可用于开发治疗ccRCC的靶点。
中国科学技术大学附属第一医院张传杰博士、复旦大学附属华山医院杜尊国副教授、上海交通大学医学院附属瑞金医院高轶副教授为本文共同第一作者;复旦大学药学院李清泉教授为本文的通讯作者。
论文链接:https://doi.org/10.1016/j.cmet.2024.01.018




