原发性胆汁性胆管炎(PBC)病理过程是慢性淤胆性胆管细胞损伤的典型代表,主要累及肝内小胆管,导致胆管增生反应和小胆管周围纤维化,可进一步发展为肝纤维化和终末期肝病。女性PBC的发病率约为男性的10倍。熊去氧胆酸(UDCA)仅能改善部分患者的症状,而不能有效阻止病理过程的进展。近期,复旦大学基础医学院病原生物学系吴健教授课题组与病理学系刘秀萍教授团队合作,在Clinical and Molecular Hepatology期刊在线发表题为“JCAD deficiency attenuates activation of hepatic stellate cells and cholestatic fibrosis ”的研究论文,揭示了JCAD在PBC肝纤维化发展过程中的重要作用。Clin Mol Hepatol主编专门邀请同行专家为此文配备编者按(Editorial)。
冠状动脉疾病有关的连接蛋白(JCAD)是一细胞连接蛋白,与钙黏蛋白(E-cadherin)共同构成内皮细胞间的紧密连接,在种系进化中高度保守,在动脉粥样硬化、冠心病、及血栓形成等病理过程发挥重要作用。该课题组前期发现代谢障碍脂肪性肝病相关肝细胞癌(MASH-HCC)标本及多种肝癌细胞系高表达JCAD,后者通过抑制LATS2的磷酸激酶活性,从而促进细胞增殖并参与肿瘤形成过程(Cancer Res 2017)。本研究进一步发现JCAD是胆汁淤积性肝纤维化中的正向调控因子。通过肝星状细胞(HSC)特异性JCAD敲除,研究人员有效地阻止了胆管结扎引起的肝纤维化,并揭示其潜在机制与HSC中抑制的Hippo-YAP信号通路活性有关。该发现为开发针对胆汁淤积性肝纤维化的分子干预手段提供了重要线索。
该团队首先通过免疫荧光双重染色证实JCAD在PBC患者肝组织中呈现高表达,并在胆汁淤积小鼠肝脏中显著上调,JCAD表达与肝星状细胞标记重叠。接着通过胆管结扎诱导了野生型小鼠、全身JCAD敲除小鼠以及HSC特异性JCAD敲除小鼠胆汁淤积性损伤和门脉区域胆管纤维化,这一模型在病理学方面较好地模拟了人类淤胆汁性胆管损伤。病理组织学和小鼠血清生化测试进一步表明,JCAD敲除显著减轻胆汁淤积性肝损伤和纤维化程度,证实JCAD对肝星状细胞的活化、增殖和细胞外基质合成等具有正向调控作用。
机制研究发现胆汁可以直接刺激肝星状细胞表达JCAD,而JCAD-Hippo-YAP信号通路在调控肝星状细胞的增殖和活化过程中起关键作用。JCAD与磷酸激酶LATS1/2结合,抑制其激酶活性,降低转录因子YAP的磷酸化水平,未磷酸化的YAP入核增加,激活下游靶基因,如结缔组织生长因子(CTGF)和Cyclin D1等,从而促进HSC的增殖和活化以及细胞外基质合成(图-1)。JCAD敲除有效抑制了胆管结扎诱导的小鼠肝纤维化,进一步证明JCAD在胆汁淤积性肝纤维化中的重要作用。
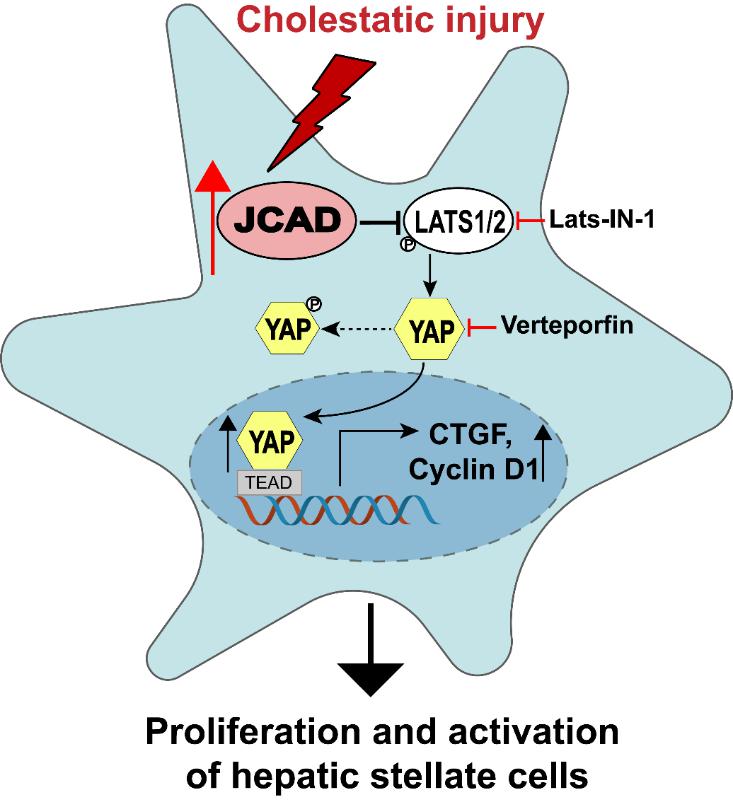
图-1. 胆汁淤积性肝损伤时JCAD通过HIPPO-YAP信号通路介导肝星状细胞活化与增殖的机制示意图
综上所述,该研究阐明了JCAD可作为干预胆汁淤积性肝纤维化的潜在靶点,并为开发针对PBC的治疗策略提供了新的理论基础。
该论文通讯作者为复旦大学基础医学院病原生物学系/附属中山医院消化科双聘教授/上海市肝病研究所脂肪肝及代谢性疾病研究实验室主任吴健医学博士,复旦大学基础医学院病理学系刘秀萍教授为共同通讯作者。复旦大学基础医学院病原生物学系博士生谢黎、陈慧和张荔为共同第一作者。
原文链接:https://e-cmh.org/journal/view.php?doi=10.3350/cmh.2023.0506





