5月8日,复旦大学药学院邵黎明教授团队的研究文章《中国创新药在美国的临床研发进展》(Development of Chinese innovative drugs in the USA)在Nature Reviews Drug Discovery上在线发表。文章通过分析2007-2023年中国创新药在美国开展临床试验的情况,展示了近17年来中国正在加快从制药大国迈向制药强国,中国药品监管体制改革和推动创新药发展的努力进入收获期。复旦大学药学院2021级博士生戈乾玮为本文第一作者,复旦大学药学院、上海市药物研发协同创新中心主任邵黎明教授为本文通讯作者。

2007-2023年期间,共有177家中国本土药企的350款原研创新药在美国开展了针对499个适应症的691项临床试验,包括I期临床试验399项(49%),II期临床试验269项(39%)和III期临床试验83项(12%)。有6款中国创新药(共计10个适应症)获得美国FDA批准上市:百济神州的泽布替尼(2019)、传奇生物的西达基奥仑赛(2022)、天济医药的本维莫德(2022)、君实生物的特瑞普利单抗(2023)、和黄医药的呋喹替尼(2023)和亿一生物的艾贝格司亭α(2023)。
创新药类型及适应症总览
在350款原研创新药中,有182款(52%)新分子实体(new molecular entities, NMEs)、162款(46%)新生物制品(new biologics)和6款(2%)中药。其中,小分子药物和单克隆抗体分别占比45%和22%;双克隆抗体占比8%,抗体-药物偶联物占比7%,细胞与基因治疗占比5%。
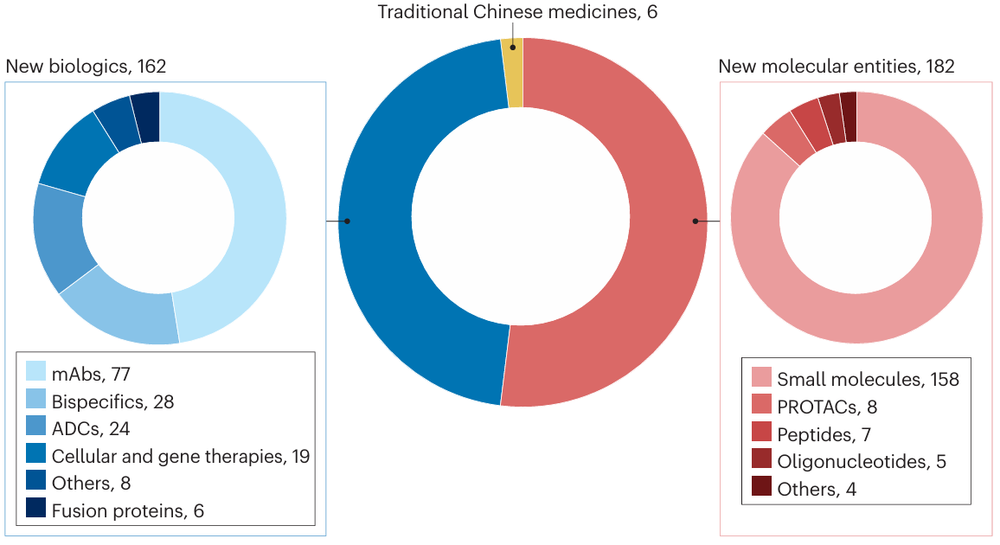
创新药总览(按药物类型划分)
肿瘤领域是中国制药企业药物研发布局的重点。在350款原研创新药开展的691项临床试验中,共有230款(66%)药物开展了358项(72%)与肿瘤适应症相关的临床试验。抗肿瘤药物的Top5靶点依次为PD-1,EGFR,PD-L1,HER2和Claudin 18.2。
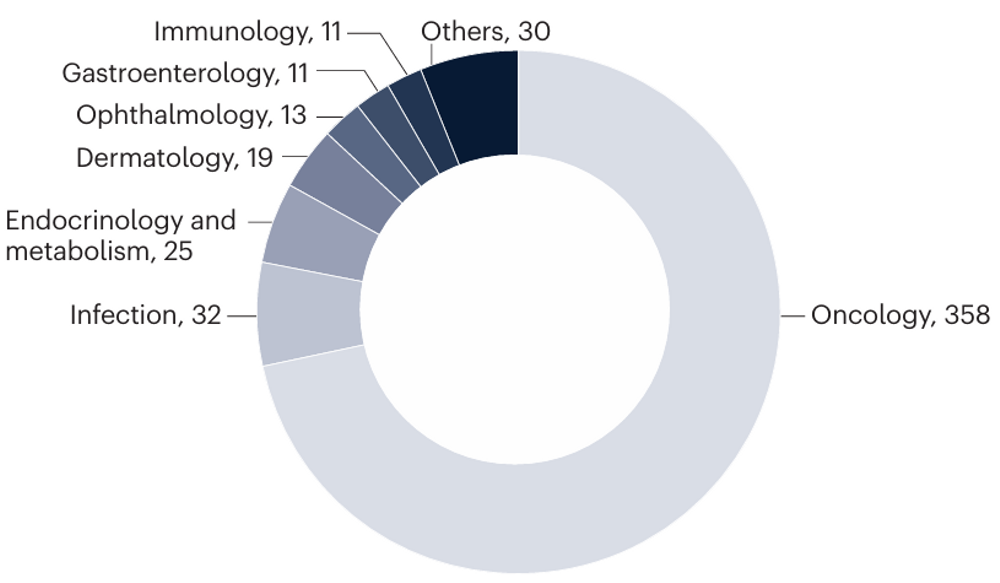
创新药开展临床试验的适应症统计
临床试验总体趋势
中国创新药在美国开展的临床研究大部分(82%)于2019-2023年启动,数量增长快速。相较于III期临床试验,开展的I期和II期临床试验数量增速更快,反映了药物研发的损耗率;不同阶段的临床试验启动数量在2021年后均有所降低。
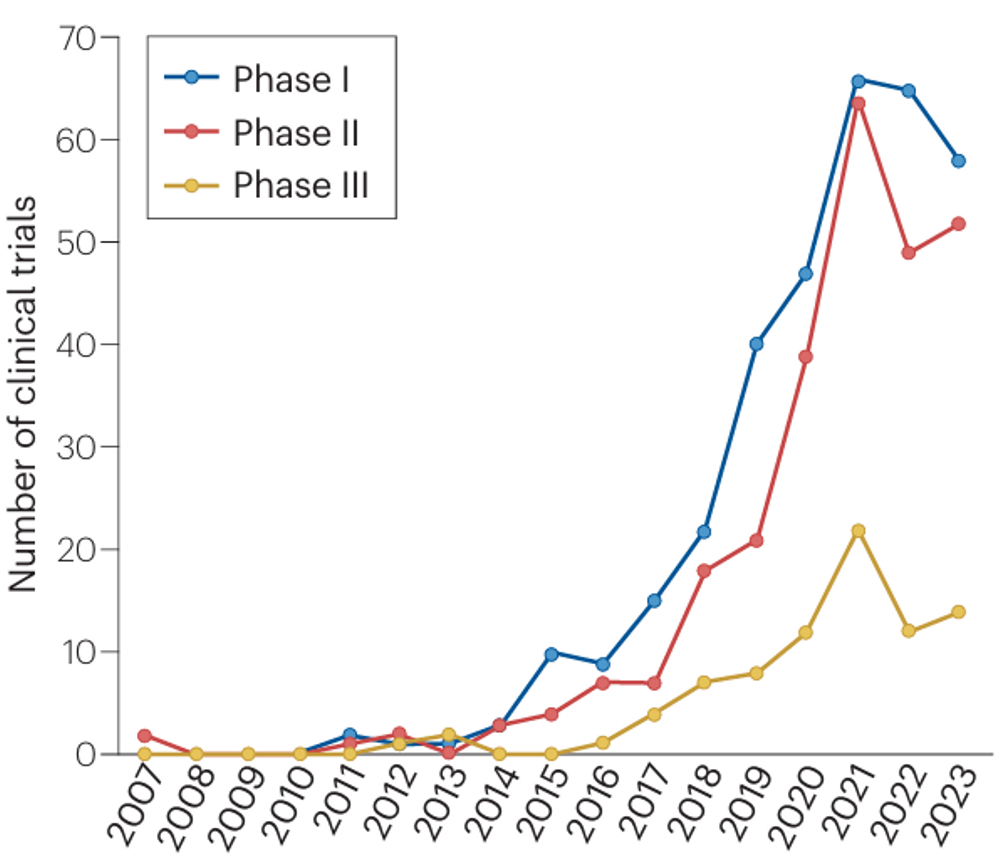
临床试验启动数量(2007-2023)
在691项临床试验中,481项(70%)的申办者是中国原研公司,188项(27%)的申办者是境外合作单位,22项(3%)的申办者是境内合作单位。随着药物研发阶段的推进,境外合作单位申办的临床试验数量占比增加(从I期临床试验的19%增加到III期临床试验的40%)。
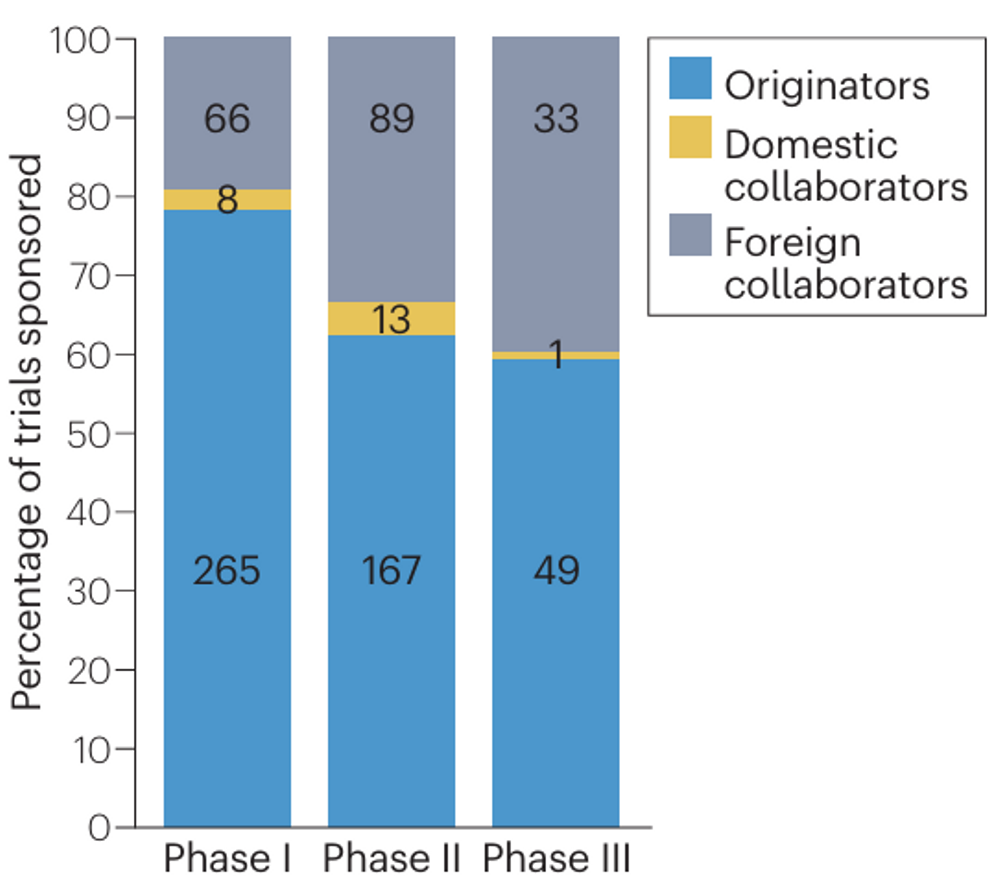
临床试验申办单位
研究团队围绕每一款药物针对其特定适应症开展的临床试验进行了分析,计算了临床开发成功率。在2007-2023年间,共有34家公司的75个新药研发项目(其中有45个新药研发项目适应症与肿瘤相关,占比60%)发生了311次临床阶段的转化。II期临床试验的成功率为17%,远低于I期的41%和III期的36%;向监管部门提交上市申请、成功获批上市的概率达67%。
综上,中国创新药在美国的临床开发成功率为1.7%。
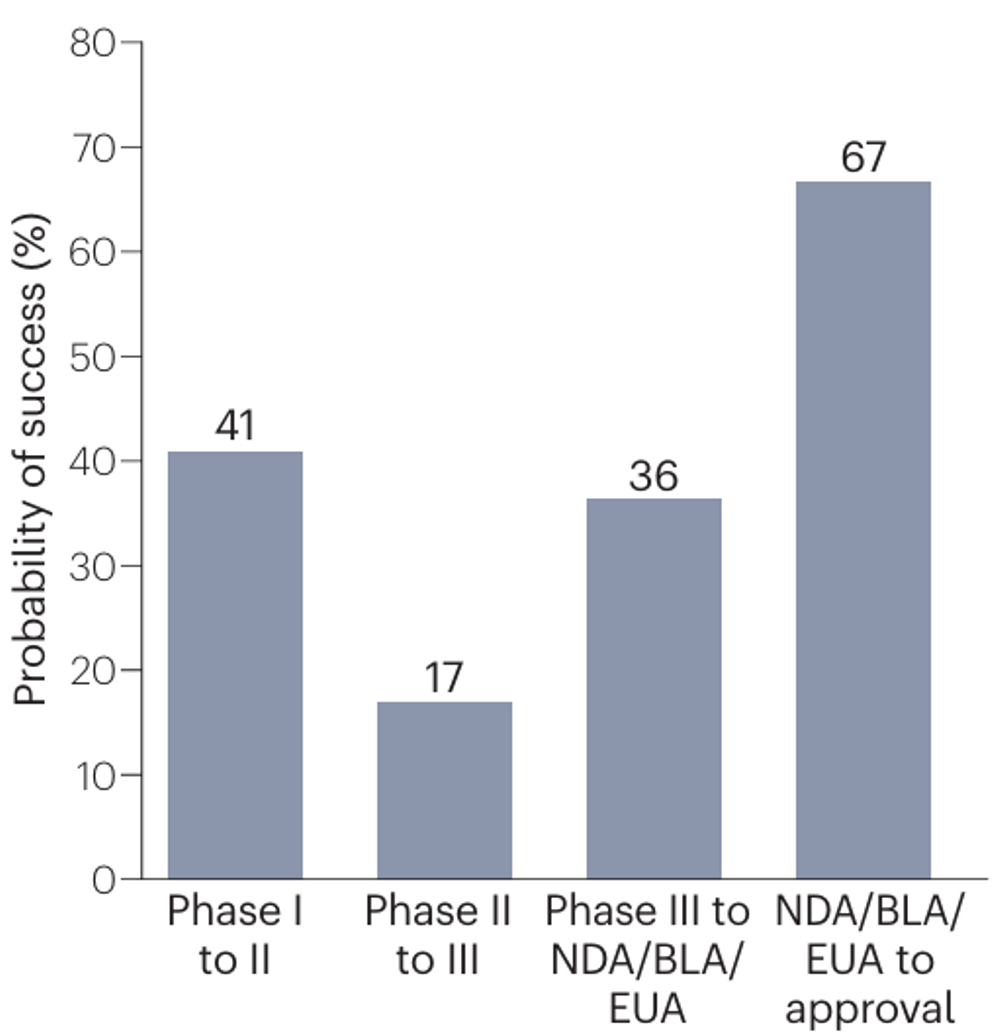
创新药的临床开发成功率
此外,有14个新药研发项目未在美国开展/完成III期临床试验,直接向监管部门提交上市申请,获批上市的概率为50%。例如,传奇生物的西达基奥仑赛成功获得美国FDA批准上市,主要基于其关键性临床1b/2期CARTITUDE-1的研究结果。
研究团队分别计算了新分子实体和新生物制品的临床开发成功率。新生物制品的I期临床试验成功率远低于新分子实体的I期临床试验成功率(16% vs. 49%);新生物制品的III期临床试验成功率高于新分子实体的III期临床试验成功率(50% vs. 31%)。
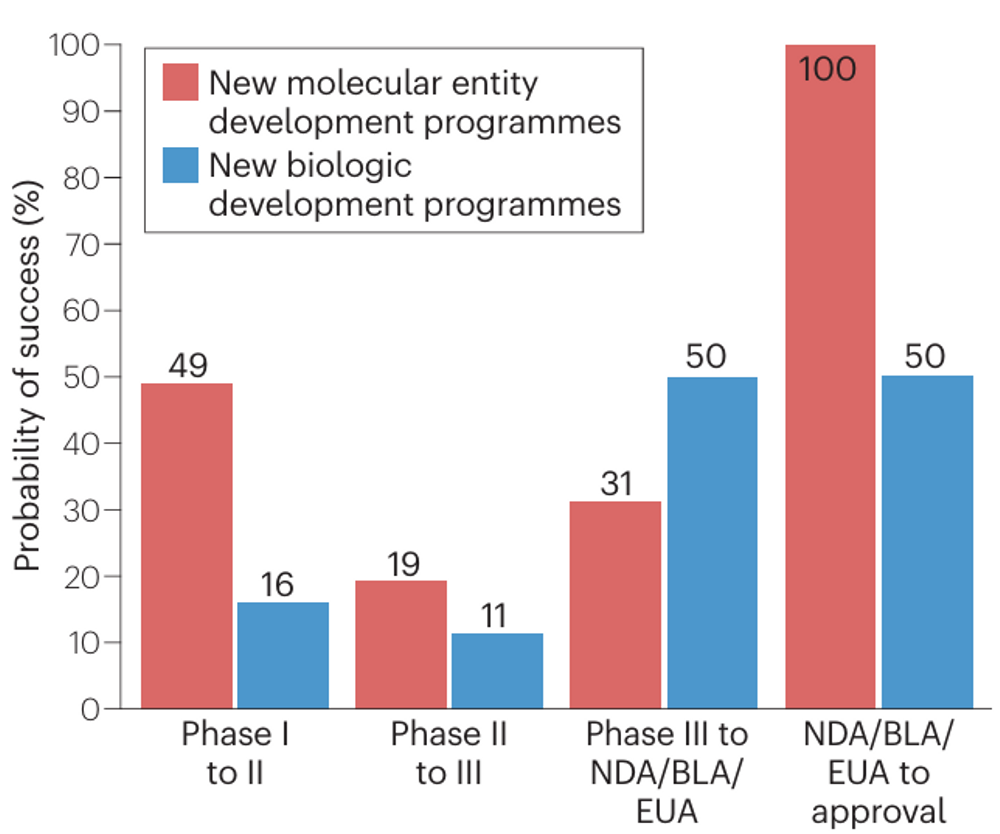
新分子实体和新生物制品的临床开发成功率
结语
科技进步、基础设施和医药创新生态的改善以及药品监管体制的改革,推动了中国新药研发水平的提高。努力提高创新质量,向差异化疗法和平台迈进,对于中国制药企业成为全球药物研发的重要参与者尤为关键。




