乙型肝炎病毒(Hepatits B virus, HBV)感染所致慢性乙型肝炎(Chronic Hepatitis B, CHB)是严重危害人类健康的公共卫生问题,可引发肝纤维化、肝硬化甚至肝癌。由于乙肝病毒共价闭合环状DNA(cccDNA)难以被彻底清除,以及HBV整合(intHBV)的存在,导致慢乙肝难以被彻底治愈;循环中高水平乙肝表面抗原(HBsAg)持续存在导致免疫耐受,则进一步促进了乙肝感染慢性化。因此现阶段乙肝的治疗目标是通过有限疗程的治疗实现HBsAg血清清除,即“功能性治愈”。RNA干扰(RNAi)疗法可选择性诱导特异性靶向序列转录本mRNA降解,导致基因表达沉默,在HBV感染治疗中展现出广阔应用前景。然而HBV小干扰核酸(siRNA)药物研发仍面临着病毒基因型众多、病毒逃逸突变和循环中稳定性差等挑战,迫切需要设计广泛针对HBV多种基因型并同时抑制乙肝表面抗原表达和cccDNA活性转录的siRNA以及开发安全高效的递送系统,以提高乙肝病毒感染治疗效果。
近日,复旦大学上海医学院袁正宏教授、占昌友教授联合上海交通大学医学院付炜研究员在国际期刊Signal Transduction and Targeted Therapy发表了题为“Optimized RNA interference therapeutics combined with interleukin-2 mRNA for treating hepatitis B virus infection”的研究论文,该研究为提升慢乙肝治疗效果提供了新策略和新思路。

该研究旨在开发一种针对HBV的全基因型(基因型覆盖度>98%)、全靶点覆盖(可靶向所有cccDNA和intHBV来源转录本)的功能性小干扰RNA(siHBV)以弥补临床现阶段同类药物的不足,结合低免疫原性、低非靶细胞摄取的改良脂质纳米粒(tLNP)平台实现其体内高效、安全、肝细胞靶向输送(tLNP/siHBV),并验证了其在多种细胞系和小鼠模型中的疗效和安全性;同时探索了基于改良脂质纳米粒(tLNP)共同递送siRNA与白细胞介素-2 mRNA(tLNP/siHBVIL2)联合治疗慢乙肝的新策略。
研究团队通过分析HBV全基因组保守序列,设计并筛选可针对HBV高保守序列、同时高效抑制乙肝表面抗原、HBV整合和乙肝病毒x蛋白(HBx)的一系列siRNA,在多种HBV相关细胞模型(HepG2-HBV/EGFP:分泌cccDNA来源HBsAg;PLC/PRF/5:分泌intHBV来源HBsAg)中评价序列及序列组合功效,筛选得到优选的序列和序列组合,并对其进行化学修饰筛选以提高其血液稳定性、确保疗效和安全性(简称“siHBV”)。所得siHBV序列组合具有广泛的基因型覆盖度(>98%)、较低的脱靶效应和细胞毒性,且可实现同时靶向所有cccDNA及intHBV来源的HBV RNA,为慢乙肝治疗提供了一种具有显著优势的新siRNA候选药物。
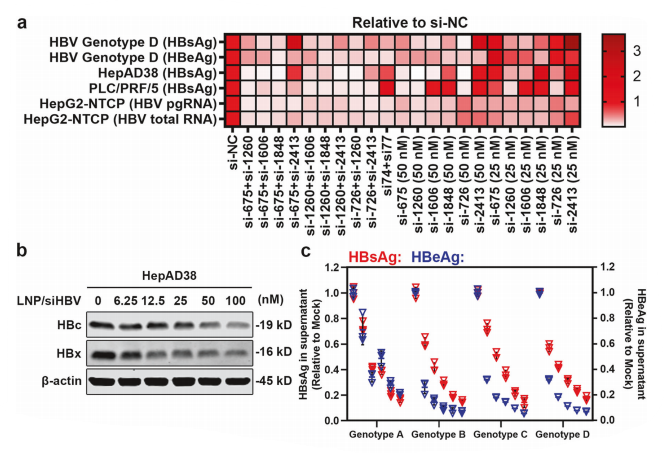
图1 功能性siRNA的设计、筛选和体外评价
基于研究团队前期发现人血中广泛存在的抗聚乙二醇(PEG)抗体显著影响用于核酸药物递送的脂质纳米粒的体内性能(即存在“PEG困境”),研究团队率先发现羟基PEG(OH-PEG)化脂质具有较低的抗PEG抗体结合活性。在抗PEG抗体存在下,与临床常用的甲氧基PEG(OMe-PEG)修饰LNP相比,OH-PEG脂质修饰LNP可显著降低抗PEG抗体的吸附及其后续补体激活,提升载药稳定性,具有较低的免疫反应性。进一步通过优化传统LNP处方中PEG脂质的端基(OMe/OH-PEG)和比例(1.5%/3%),并对含不同端基/比例PEG脂质的LNP进行药效学、组织分布、细胞摄取等体内性能的研究,以靶向肝细胞特异性载脂蛋白的siRNA(siApoB)为模式siRNA,筛选得到具低免疫反应性和优化体内性能的新型LNP(简称“tLNP”,含3% OH-PEG2000-DMG),可有效规避与人预存抗PEG抗体结合,同时实现在肝实质细胞中高效安全的递送。
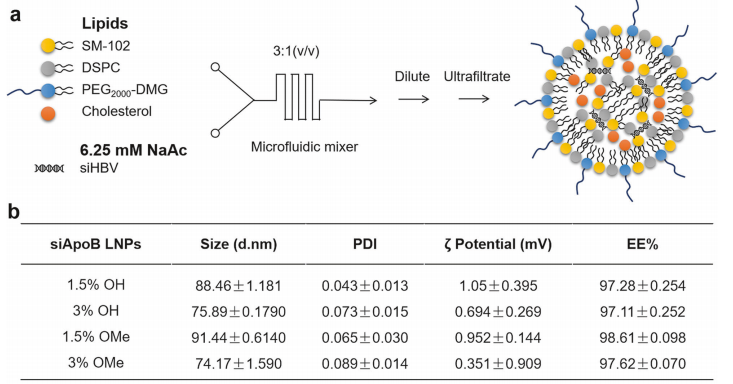
图2 改良脂质纳米粒(tLNP)平台的筛选和评价
结合上述筛选的高效安全核酸递送载体tLNP以及设计合成的功能性siHBV,构建tLNP包载siHBV的核酸药物(简称“tLNP/siHBV”),并在AAV-HBV1.3(慢性乙肝小鼠模型)和团队特有的AAV-rcccDNA/AAV-Cre(慢性重组cccDNA小鼠模型)等模型中对其抑制乙肝病毒的疗效和安全性进行了考察。结果显示单一剂次tLNP/siHBV可显著抑制慢乙肝小鼠模型中血清HBsAg、HBeAg和HBV DNA水平,且呈剂量依赖性。在上述模型中以1mg/kg给药剂量、每周一次(Q1W)给药频率重复给药可实现HBsAg、HBeAg和HBV DNA持续抑制。
尽管RNAi和抗体介导的HBsAg清除可通过降低病毒负担减轻HBsAg所致免疫功能障碍,但都无法激活病毒特异性T细胞以实现长期病毒控制;临床上仅有极少数患者经RNAi治疗后产生HBsAg抗体。为有效延缓停药后抗原表达和病毒DNA水平回升,研究团队进一步探索RNAi与细胞因子白细胞介素-2(IL-2)联合使用,通过tLNP共包载siHBV和IL-2 mRNA获得新型核酸药物(简称“tLNP/siHBVIL2”),并评估其治疗乙肝病毒感染的疗效、安全性并探讨机制。结果显示tLNP/siHBVIL2表现出持续的HBV抑制和HBV特异性免疫调节效果。机制研究表明,tLNP/siHBVIL2可通过RNAi途径抑制病毒转录复制,并通过高效表达IL-2促进HBV特异性CD8+及CD4+ T细胞增殖和浸润,从而同时实现了对HBV病毒的抗原抑制和免疫控制。
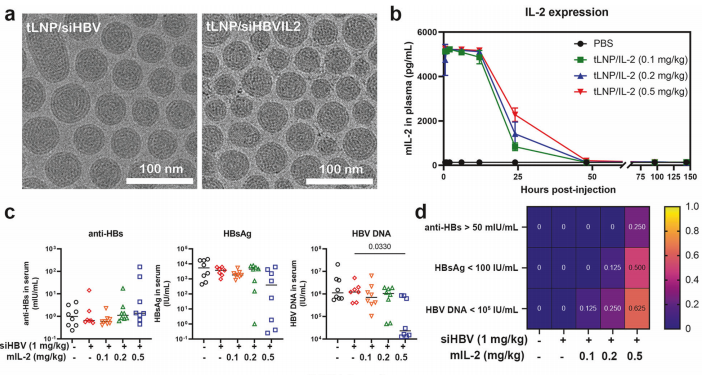
图3 siHBV+IL-2 mRNA共递送系统(tLNP/siHBVIL2)的构建和评价
综上所述,本研究设计了一种针对HBV的高效、多功能、高保守的siRNA序列组合(siHBV),结合具有低免疫原性、低非靶细胞吞噬等特征的改良脂质纳米粒(tLNP)平台,实现了siHBV体内高效、安全、肝细胞靶向输送,并在多种乙肝相关细胞模型和动物模型中验证了其疗效和安全性;进一步利用脂质纳米粒载体可灵活包载不同核酸的特性,将siHBV与编码小鼠白细胞介素-2(mIL-2)的mRNA封装在单一tLNP制剂中,实现了病毒抗原抑制与免疫控制。该研究为开发新的抗乙肝病毒策略和治疗药物提供了理论基础和技术支撑,也为该通用型低免疫反应性高性能脂质纳米粒(tLNP)在核酸药物治疗领域的临床推广提供新思路。
该研究得到了国家自然科学基金重大研究计划、中国医学科学院医学创新基金、广东省珠江人才计划地方创新团队项目、上海市科委基础研究重大专项等项目的资助。复旦大学上海医学院袁正宏教授、占昌友教授,上海交通大学医学院附属上海儿童医学中心付炜研究员为该论文的共同通讯作者,宰文静、杨敏为共同第一作者,核心成果已申报发明专利。




