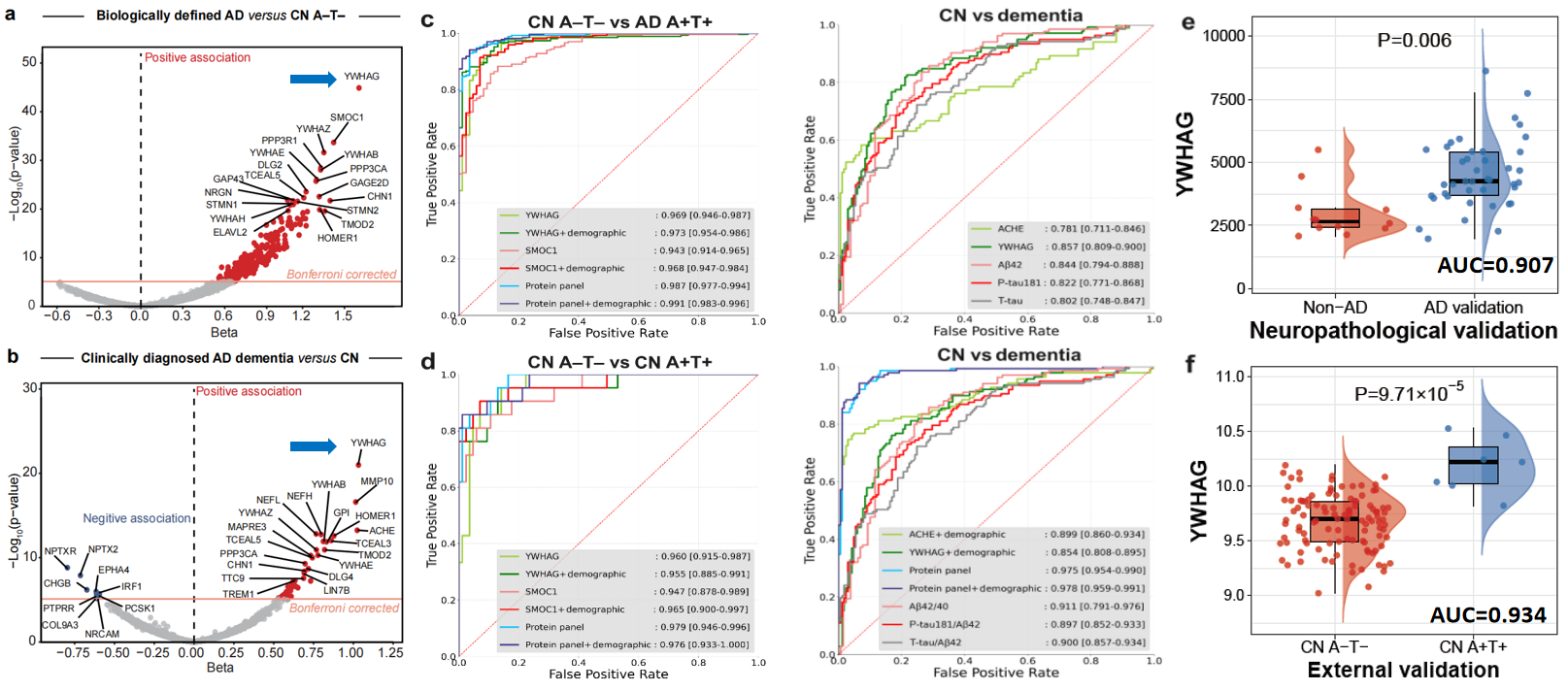
图:脑脊液蛋白对阿尔茨海默病诊断的准确度及外部队列验证和尸检病理验证结果
近期,由复旦大学附属华山医院神经内科郁金泰教授团队领衔,联合复旦大学类脑智能科学与技术研究院的冯建峰/程炜团队运用AI for Medicine(AI4M,人工智能驱动的医学研究)创新思路和分析策略,对迄今为止最大规模的高通量脑脊液蛋白质组学(6361种蛋白)数据进行分析建模,发现了对阿尔茨海默病(AD)诊断和预测具有重要价值的新型生物标志物——YWHAG。结果显示,YWHAG在识别生物学定义的AD和临床诊断的AD痴呆时的准确度分别高达96.9%和85.7%,联合四个(YWHAG、SMOC1、TMOD2和PIGR)和五个(ACHE、YWHAG、PCSK1、MMP10和IRF1)蛋白的组合进一步将诊断准确性提高到98.7%和97.5%。这些卓越的诊断性能在独立外部队列及尸检病理队列中均得到了验证,甚至优于经典的AD脑脊液核心生物标志物Aβ42和P-Tau181。该发现具有较高的临床应用价值,此项研究成果于2024年7月10日发表在《自然-人类行为》(Nature Human Behavior)杂志。
早期诊断,精准治疗
近年来,针对β淀粉样蛋白(Aβ)的疾病修饰治疗取得了重大进展,越来越多的AD靶向精准治疗药物获批上市,为早期AD患者提供了新的精准治疗选择。这些靶向Aβ的新药有望显著改善AD的治疗现状,但其临床应用也为医生带来了一系列新的挑战。首先,这些新药主要在早期AD患者中发挥药效,因此准确识别早期AD患者至关重要。早期诊断是实现精准治疗的关键,这对现有的诊断方法提出了前所未有的高要求。其次,由于这些新药价格昂贵且仍存在一定风险,进一步改进诊断技术以确保药物的有效应用显得更加紧迫。郁金泰教授团队的最新研究成果为基于生物标志物的AD早期精准诊断提供了强有力的支持,从而有助于患者在疾病初期得到及时和有效的治疗。
AI赋能,精准标志物
随着全球老龄化进程的加剧和人类寿命的延长,AD患病率高且逐年增长,给患者、家庭和社会带来了沉重的经济和照料负担。尽管目前的生物标志物研究取得了重要进展,但AD的病理生理学特征在很大程度上仍不清。Aβ斑块和tau神经元纤维缠结被公认为AD的两大重要病理指征,但它们仅反映了AD错综复杂的病理生理过程的一部分,拓展对AD生物标志物的认识变得尤为重要。脑脊液蛋白质组学方法为挖掘AD复杂潜在病理改变提供了一个不可或缺的系统工具。
郁金泰教授团队运用AI for Medicine(人工智能驱动的医学研究),采用创新的数据驱动方法和独特的蛋白质组学分析策略,对6361种脑脊液蛋白组学数据进行了分析和建模,从而挖掘出对AD诊断具有重要价值的新型生物标志物,为AD早期精准诊断提供了可能。
基于大样本队列数据,研究纳入了认知正常、轻度认知障碍和AD共707名参与者。通过对SomaScan平台检测的脑脊液蛋白质组学数据进行深入分析挖掘,郁金泰教授团队在6361个蛋白质中筛选出对AD生物学诊断和临床诊断最重要的生物标志物,分别为YWHAG、SMOC1、TMOD2和PIGR这四个蛋白和ACHE、YWHAG、PCSK1、MMP10和IRF1这五个蛋白。与对照组相比,脑脊液YWHAG无论是在生物学定义的AD组,还是在临床诊断的AD痴呆组,其差异表达均最显著。单独YWHAG、SMOC1和TMOD2以及上述四个和五个蛋白分别组成的panel对生物学和临床定义的AD均表现出良好的诊断性能。在单个蛋白中,YWHAG在识别生物学定义的AD和临床诊断的AD痴呆时表现最佳,准确度分别高达96.9%和85.7%。使用四个和五个蛋白分别组成的组合进一步将诊断准确性提高到98.7%和97.5%。重要的是,YWHAG、SMOC1、TMOD2和两种蛋白组合的卓越性能不仅在独立的外部队列中得到了验证,而且在区分尸检病理证实的AD与非AD时也得到了验证,甚至优于经典的AD脑脊液核心标志物(Aβ42、p-tau181、t-tau)以及这三种经典标志物的组合。除了卓越的诊断效能,它们在预测AD临床进展方面也表现良好,与AD核心病理和认知能力下降密切相关。
重大突破,广阔前景
此次研究成果不仅为AD的早期诊断和疾病预测提供了全新的生物标志物,更在临床应用和未来研究方面展现了广阔的前景。该发现不仅突破了传统AD诊断标志物的局限性,还显著提高了诊断的准确度。这一创新研究不仅仅是学术上的突破,更是向着AD精准医疗迈出了坚实的一步。新的生物标志物不仅在独立的外部队列中表现优异,还在尸检病理队列中得到了验证,甚至优于现有的经典AD标志物。如此高的诊断准确性,为未来的临床实践提供了有力支持,有望大幅提高AD患者的早期识别,进而优化治疗方案,延缓疾病进展,改善患者生活质量。
此外,这些新发现的生物标志物不仅限于脑脊液研究,还可能在血液检测中展现出同样的诊断潜力。目前,相关的血液YWHAG研究已经在进行中,这预示着更加便捷、非侵入性的AD诊断方法或许将在不久的将来成为现实。相关成果已申请专利,具有巨大的应用空间和市场转化潜力。
通过AI和大数据的赋能,发现的精准诊断的新指标,将极大地推动AD精准医疗的发展。郁金泰教授团队结合创新的蛋白质组学分析策略与先进的人工智能技术,成功挖掘出具有重要临床意义的新型生物标志物。这一成果的取得,是团队多年潜心研究、不断创新的结果,也体现了跨学科合作的强大力量。团队在AD预防、诊断和治疗方面积累了丰富的经验,并通过大量高质量的临床研究工作,不断推进AD精准医学的发展。此次研究不仅揭示了AD的复杂病理机制,还为临床医生提供了精准识别AD患者的科学依据,使得早期精准诊断和治疗成为可能,从而显著提高了患者的生活质量。
论文链接:https://www.nature.com/articles/s41562-024-01924-6




