间充质干细胞源性胞外囊泡(MSC-EVs)在组织再生中的重要作用已被普遍认可。细胞外囊泡(EVs)具有普遍的异质性,其包裹的内容物及其功能继承于亲代细胞。对间充质干细胞进行免疫刺激可增强其免疫调节功能,进而推测免疫刺激的MSC-EVs也有更强的免疫调节功能。

近期,上海市口腔医院·复旦大学口腔医学院刘月华教授团队联合复旦大学陈新教授团队在国际材料科学期刊Advanced Healthcare Materials上发表题为“Enhanced Tissue Regeneration Through Immunomodulatory Extracellular Vesicles Encapsulated in Diversified Silk-Based Injectable Hydrogels”的论文(2024 Jul 16:e2401460),介绍了一种多样化丝蛋白可注射水凝胶体系,可通过包载具有增强免疫调节功能的干细胞源性胞外囊泡促进软硬组织缺损修复。
研究人员首先比较常规培养的骨髓间充质干细胞源性胞外囊泡(N-EVs)和用LPS免疫刺激的骨髓间充质干细胞源性胞外囊泡(L-EVs)对脂多糖(LPS)诱导下巨噬细胞极化的影响,发现L-EVs能显著促进巨噬细胞从促炎M1表型向抗炎M2表型极化,同时免疫刺激后L-EVs的分泌量也显著增多。随后,研究人员开发了一种简便快捷的再生丝蛋白(RSF)水凝胶制备方法,通过调节超声预处理时间大幅缩短成凝胶时间,并用溶胶态水凝胶直接重悬L-EVs沉淀,从而在不影响EVs生物活性的情况下使其在水凝胶中具有良好的分散性和缓释性。RSF具有优良的生物相容性和可调的降解性,而锂藻土(LAP)可显著促进成骨。研究团队提出,根据不同组织缺损类型,可使用与之适配的水凝胶体系以获得更好的修复效果,结果表明RSF/L-EVs水凝胶和RSF/LAP/L-EVs水凝胶分别可显著促进大鼠皮肤缺损及牙槽骨缺损修复。最后,研究人员对L-EVs促进巨噬细胞M2型极化的分子机制进行了探索,发现L-EVs可通过抑制关键代谢酶PKM2的核移位抑制下游炎症相关信号通路激活,进而发挥其免疫调节功能。
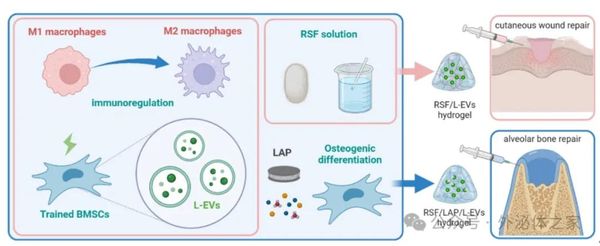
示意图:样化丝蛋白水凝胶体系搭载免疫刺激的干细胞源性胞外囊泡促进软硬组织缺损修复
上海市口腔医院·复旦大学口腔医学院孙良䶮和复旦大学肖梦林为该文章第一作者,上海市口腔医院·复旦大学口腔医学院刘月华教授、赵丙姣主任医师和复旦大学陈新教授为共同通讯作者。
文章链接:
https://doi.org/10.1002/adhm.202401460




