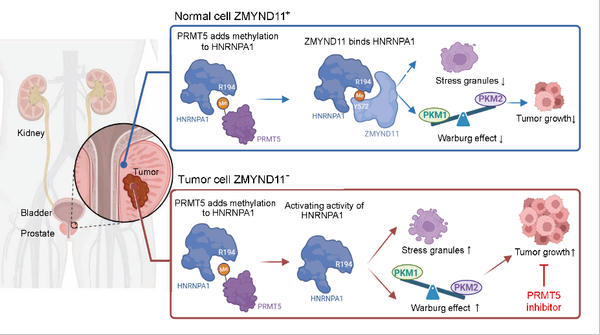
表观遗传修饰在肿瘤的发生与发展过程中扮演了至关重要的角色。组蛋白H3K36的甲基化修饰(H3K36me)是重要的表观遗传标记之一,其中H3K36me3的研究较为深入,主要在基因区富集,具有多种功能,包括调控转录起始、影响pre-mRNA剪切以及抑制异常转录等。在组蛋白家族中,H3的变体H3.3尽管与常规H3仅存几处氨基酸差异,但H3.3能够经由特异性分子伴侣介导,整合到染色质的特定区域,从而发挥与H3不同的生物学功能。H3.3K36me3的特异性读码器ZMYND11近年来在癌症研究中引起了广泛关注。例如,在乳腺癌中,ZMYND11通过在转录延伸阶段调节RNA聚合酶II的活性,发挥了转录辅抑制因子的功能,这提示ZMYND11具有潜在的抑癌基因特性。然而,迄今为止,对于ZMYND11的研究主要集中在其作为组蛋白H3.3K36me3修饰读码器的功能,而它在转录调控以外的生物学功能仍知之甚少。进一步研究ZMYND11的多功能性,特别是在表观遗传调控之外的潜在作用,将有助于全面理解其在肿瘤中的生物学功能。
2024年9月28日,复旦大学基础医学院卫功宏课题组在Signal Transduction and Targeted Therapy期刊上发表了题为“Epigenetic reader ZMYND11 noncanonical function restricts HNRNPA1-mediated stress granule formation and oncogenic activity”的研究论文。该研究首次揭示了ZMYND11作为非组蛋白HNRNPA1甲基读码器的非经典新功能,发现精氨酸甲基化介导的ZMYND11-HNRNPA1-PKM2轴限制肿瘤进展的机制,并提出了ZMYND11具有作为癌症治疗靶点的潜在应用场景,特别是在肿瘤环境中,蛋白精氨酸甲基转移酶PRMT5抑制剂被提出为一种可能的临床治疗手段。

研究者首次揭示了ZMYND11作为非组蛋白甲基读码器的非经典功能,具体通过识别HNRNPA1的精氨酸甲基化修饰调控肿瘤代谢和进展。研究发现,精氨酸甲基化酶PRMT5通过介导ZMYND11与HNRNPA1的相互作用,进而影响PKM2的可变剪接,抑制肿瘤细胞的有氧糖酵解(Warburg效应)。这一“ZMYND11-HNRNPA1-PKM2轴”的新机制为理解肿瘤代谢调控提供了重要依据,并表明ZMYND11具有作为癌症治疗靶点的潜力。此外,PRMT5抑制剂通过阻断该相互作用,显示出对ZMYND11低表达肿瘤的显著治疗效果,提供了重要的临床应用前景。
综上所述,本研究突破了人们对ZMYND11作为组蛋白H3.3K36me3修饰读码器的传统认知,扩展了其功能至非组蛋白甲基化调控领域。这一发现显著改变了我们对表观遗传读码器的理解,表明表观遗传修饰不仅限于组蛋白调控,还可能涉及广泛的非组蛋白靶点和机制。总之,ZMYND11的发现为表观遗传调控领域开辟了新的研究方向,并为癌症治疗策略的开发提供了重要的基础。未来的工作将进一步揭示更多表观遗传读码器的非经典功能,推动这一领域的深入发展。
复旦大学附属肿瘤医院肿瘤研究所研究助理、基础医学院生物化学与分子生物学系博士生连丞和张春翌副教授为该论文的共同第一作者。复旦大学肿瘤研究所和基础医学院生物化学与分子生物学系卫功宏教授为该论文的通讯作者。该工作得到了国家自然科学基金、科技部重点研发计划等项目支持,以及复旦大学上海医学院大数据高性能计算平台的支持。
原文链接: https://www.nature.com/articles/s41392-024-01961-7




