国家神经疾病医学中心、复旦大学附属华山医院毛颖教授团队与上海科技大学免疫化学研究所刘海坤/吴永和教授团队联合,历时4年多,自主研发了一款新型的个体化脑肿瘤类器官(IPTO)模型,建立了脑肿瘤类器官库,并在精准预测患者药物反应方面展现了优越性。2025年2月11日,相关研究成果《个体化脑肿瘤类器官模拟肿瘤微环境并预测患者治疗反应》(“Individualized Patient Tumor Organoids Fully Recapitulate Human Brain Tumor Ecosystems and Predict Patient Response to Therapy”)于《细胞-干细胞》(Cell Stem Cell)发表,为进一步研究脑肿瘤发生发展机制、筛选药物、制定个体化精准治疗方案提供了重要方法。这也是复旦大学附属华山医院神经外科与上海科技大学免疫化学研究所自2020年9月开展战略合作以来,通过密切结合基础研究与临床应用开展的系列重要研究之一。
肿瘤类器官是癌症研究的重要工具,能够高度重现肿瘤特征,为药物筛选、个体化治疗方案制定及研究肿瘤发生发展提供有力支持,但现有的脑瘤类器官模型存在一定局限,限制了其在临床反应预测中的应用。目前已建立的脑瘤类器官大多针对恶性胶质母细胞瘤,这些类器官虽然能够部分保留肿瘤的形态特征、细胞组成、基因组异常和侵袭性等,但未能充分模拟肿瘤细胞与正常脑组织之间的相互作用。此外,针对低级别胶质瘤(如IDH突变型)及脑转移瘤的类器官体系一直匮乏。
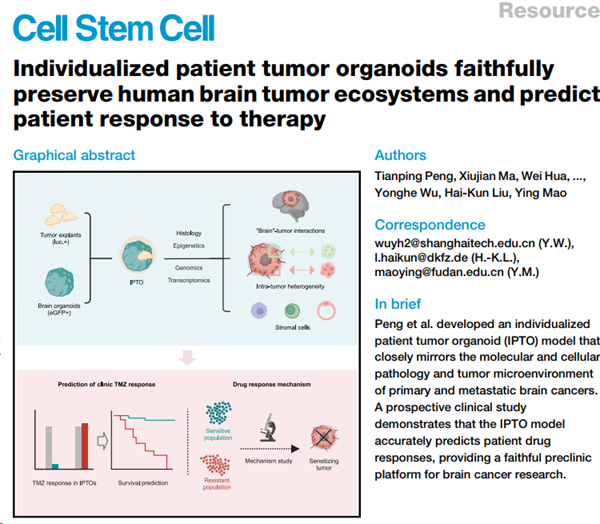
为了解决这一问题,研究团队将患者来源的肿瘤组织植入由多功能诱导性干细胞(iPSC)建立的迷你脑类器官(mini-brain)囊中,成功模拟了肿瘤细胞在体内环境中的生长与侵袭。通过这一方法,研究团队建立了包含326例脑肿瘤类器官库,涵盖了48种脑部肿瘤类型,包括各类原发良性/恶性成人肿瘤、儿童肿瘤及脑转移瘤等。组织病理学、基因组学、表观遗传学以及单细胞测序分析表明,IPTO模型能真实保留了肿瘤的异质性及分子特征,对于筛药,精准诊治,以及分子机制研究提供了几乎近似体内的环境和特点,尤其是一些偏良性、体外难以成瘤的脑肿瘤更加重要。与传统的脑瘤类器官模型相比,IPTO模型的成功率更高,能够维持肿瘤免疫微环境特别是免疫细胞细胞的组成,并高度保持肿瘤内部的空间异质性。

图:该Sunburst图展示了本研究中用于生成IPTOs的样本数量和肿瘤亚型占比,研究人员通过这种方法建立起326个病人组织来源的生物样本库,涵盖了48种中枢神经系统肿瘤类型,包括成人肿瘤,儿童肿瘤以及脑转移瘤等。
更为重要的是,研究团队开展了一项前瞻性临床验证,利用IPTO模型预测胶质母细胞瘤患者对标准化疗药物替莫唑胺的反应,结果表明IPTO模型明显优于临床上常用的指标MGMT甲基化,可以精准预测病人对化疗的反应;并且可以在2-3周内完成,表明IPTO技术成功达到了预测性临床前模型的标准,可以用于临床实践。
鉴于IPTO的独特优势,和建立初就深度结合临床的特点,本技术已经在中国、德国多家医院得到快速独立验证,并且已经可以应用到化疗、靶向治疗、免疫治疗和细胞治疗药物预测。德国合作团队也已成功把这项技术整合到TCRT临床试验流程之中。基于IPTO技术的多项国际临床应用合作也在稳步推进中。
上海科技大学免疫化学研究所癌症干细胞课题组博士研究生彭天平、德国癌症研究中心(Deutsches Krebsforschungszentrum, DKFZ) 麻秀建以及复旦大学附属华山医院花玮主任医师为本论文的共同第一作者。吴永和、刘海坤及毛颖为本论文的共同通讯作者。
原文链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(25)00002-5