2025年3月10日,复旦大学附属华山医院刘杰教授、骆菲菲研究员团队在《肿瘤细胞》(Cancer Cell)发表题为“Targeting tumor monocyte-intrinsic PD-L1 by rewiring STING signaling and enhancing STING agonist therapy”的研究论文,系统揭示了STING激动剂诱导单核细胞内源性PD-L1介导免疫抑制的全新机制,并提出通过STING信号重编程提升治疗疗效的新策略。
cGAS-STING通路是固有免疫系统识别胞质DNA并启动免疫应答的重要分子开关,其下游包括IRF3-I型干扰素(IFN-I)和NF-κB两条主要的信号轴,在肿瘤等重大慢病中发挥关键作用。靶向激活STING的策略在肿瘤免疫治疗中极具潜力,已有多种STING激动剂进入临床转化阶段。但均面临疗效有限等挑战,亟待阐明内在机制,提升疗效。

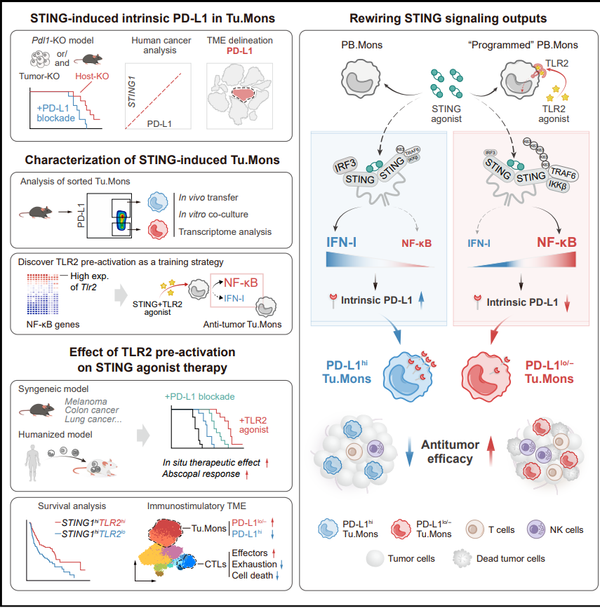
团队研究发现,STING信号激活在触发抗肿瘤免疫应答的同时,通过经典STING-IRF3-IFN-I信号轴,诱导肿瘤微环境中PD-L1high单核细胞显著扩增。这群由STING诱导的PD-L1high单核细胞体内转输可明显加速小鼠肿瘤进展,而当这群单核细胞的PD-L1被敲除时,其促癌功能转变为抑癌功能。进一步,团队利用条件性敲除模型发现,单核吞噬系统中PD-L1的缺失可系统性增强STING激动剂的抗肿瘤效果。值得注意的是,传统的PD-L1抗体通过阻断细胞表面PD-L1分子的治疗方式,仅部分抑制PD-L1high单核细胞介导的肿瘤生长。以上结果表明,STING诱导的单核细胞内源性PD-L1是其治疗抵抗的关键,为提升STING激动剂临床疗效提供靶点。
为解析STING信号上调内源性PD-L1的分子机制,团队通过对比PD-L1high、PD-L1low/–及PD-L1-KO单核细胞的转录组特征发现,STING信号通过IRF3驱动I型干扰素产生时,诱导PD-L1high促癌单核细胞形成;而通过NF-κB通路激活时,则促进PD-L1low/–抗癌单核细胞形成。基于此,团队提出通过模拟NF-κB信号“重定向”STING下游通路的治疗新理念。经筛选发现,单核细胞中高表达的TLR2信号具有作为STING调控通路的潜能。TLR2激动剂预处理可显著抑制STING诱导的PD-L1上调及促肿瘤功能。机制上,TLR2信号通过诱导STING的K63泛素化,增强其与TRAF6的相互作用,促进NF-κB活化并抑制IRF3-IFN信号轴,从而促进单核细胞转化为PD-L1low/–抗癌型细胞。在结直肠癌、乳腺癌、肺癌、黑色素瘤等多种小鼠模型,以及人源化免疫系统-肿瘤移植模型中,TLR2/STING激动剂联合治疗均显著抑制肿瘤生长,并诱导系统性抗肿瘤免疫应答。
该研究首次揭示STING下游通路之间的动态平衡决定单核细胞的功能命运,阐明单核细胞内源性PD-L1作为免疫检查点分子的非经典作用机制,并提出通过TLR2/STING信号重编程克服治疗抵抗的创新策略。
复旦大学附属华山医院消化科刘杰教授、骆菲菲研究员为该论文的共同通讯作者,宋欢住院医师、陈琳博士后、潘宣宣博士生为共同第一作者。
原文链接:https://doi.org/10.1016/j.ccell.2025.02.014