PD-1/PD-L1抑制剂在晚期高级别浆液性卵巢癌(HGSOC)中的单药客观缓解率不足15%,提示其肿瘤微环境存在独特免疫逃逸特征。研究发现肿瘤相关中性粒细胞(TAN)具有双重调控特性:既通过促血管生成及T细胞抑制促进肿瘤进展,又具备向抗肿瘤表型转化的可塑性。临床证据显示,外周血中性粒细胞/淋巴细胞比值(NLR)升高与ICB疗效负相关,而TAN表面PD-L1等免疫检查点分子的表达提示其可作为联合治疗靶点。课题组前期发现JAG2+TAN亚群与HGSOC不良预后显著相关,机制研究表明Notch抑制剂LY3039478可阻断该亚群的免疫抑制作用并增强CD8+T细胞活性。但JAG2+TAN介导免疫逃逸的分子机制及其对肿瘤微环境的重编程作用,仍是优化ICB联合策略亟待解决的关键科学问题。
2025年3月22日,复旦大学附属妇产科医院刘海鸥研究员团队在Cancer Communications杂志上在线发表了题为"Immunosuppressive JAG2+ tumor-associated neutrophils hamper PD-1 blockade response in ovarian cancer by mediating the differentiation of effector regulatory T cells" 的研究。该研究首次揭示JAG2+TAN通过JAG2/Notch1 /RBPJ轴驱动HGSOC免疫逃逸的关键机制,并提出靶向Notch信号联合PD-1抑制剂可显著逆转免疫治疗耐药,为HGSOC精准免疫治疗提供了全新策略。

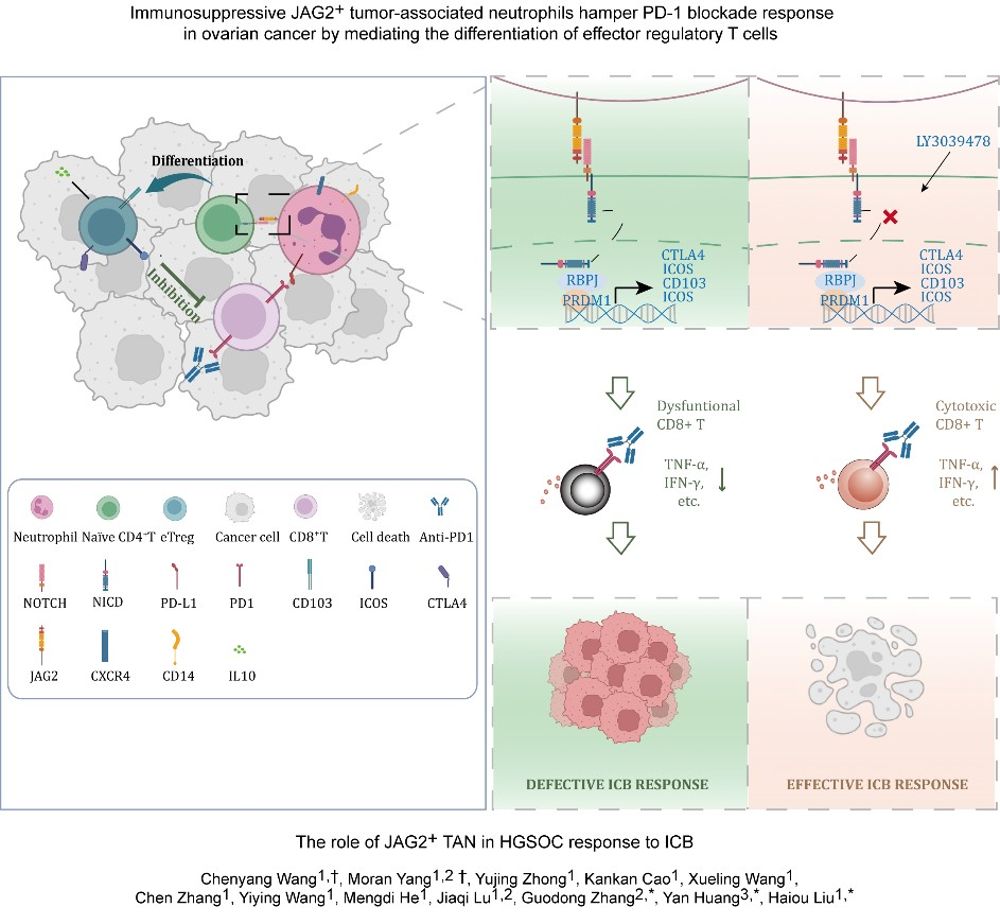
本研究首次揭示JAG2+TAN通过激活JAG2/Notch1/RBPJ信号轴,诱导效应性调节性T细胞 (eTreg)的分化程序,进而抑制CD8+ T细胞效应功能。机制层面,Notch信号通路的转录因子RBPJ介导eTrge特征基因表达,阐明了Notch通路在eTreg细胞命运决定中的核心调控作用。临床前实验证实,LY3039478和抗-JAG2单抗,可显著降低肿瘤内eTreg比例,并增强抗PD-1治疗的CD8+T细胞浸润与肿瘤生长抑制率。转化医学分析显示,JAG2+TAN高浸润患者对ICB治疗客观缓解率显著低于低浸润组,且联合eTreg标志物可构建预测模型,精准识别ICB耐药人群。基于Notch抑制剂与PD-1阻断剂的协同效应,本研究提出“双靶向免疫重塑”治疗策略,为开展JAG2/PD-1联合靶向临床试验提供了关键机制依据与疗效预测标志物。
复旦大学附属妇产科医院刘海鸥研究员、张国栋主治医师和复旦大学附属肿瘤医院黄妍主任医师为论文的共同通讯作者。复旦大学附属妇产科医院王晨阳硕士,杨默然住院医师为论文的共同第一作者。